题目内容
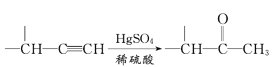
【题目】Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。回答下列问题:

(1)“滤渣1”的成分为______(写化学式)。
(2)“除铁”中,加入NaClO的目的是_________________,为了证明加入NaClO已足量,可选择的试剂是__________ (填字母标号)。
a.KSCN溶液、氯水 b.K3[Fe(CN)6]溶液 c.NaOH溶液
(3)已知“滤渣2”的成分为黄钠铁矾,其化学式为NaFe3(SO4)2(OH)6,则“除铁”
中“Na2CO3/△”条件下生成滤渣2的离子方程式为_______________。
(4)“除镁”中,若溶液pH过小,Mg2+沉淀不完全,原因是_____________。
(5)“沉镍”的离子方程式为__________。
(6)以镍钴锰三元材料(可简写为Li1-nMO2)为一极电极材料的新型锂电池工作原理如图所示,放电时总反应为Li1-nMO2+LinC6 ![]() LiMO2+6C,则充电时b极的电极反应式为____________________。
LiMO2+6C,则充电时b极的电极反应式为____________________。

【答案】SiO2 将Fe2+氧化成Fe3+ b Na++3Fe3++2SO![]() +3H2O+3CO
+3H2O+3CO![]() =NaFe3(SO4)2(OH)6↓+3CO2↑ F-与H+结合形成弱电解质HF,MgF2Mg2++2F-平衡向右移动 Ni2++2HCO3-=NiCO3↓+CO2↑+H2O LiMO2-ne-=Li1-nMO2+nLi+
=NaFe3(SO4)2(OH)6↓+3CO2↑ F-与H+结合形成弱电解质HF,MgF2Mg2++2F-平衡向右移动 Ni2++2HCO3-=NiCO3↓+CO2↑+H2O LiMO2-ne-=Li1-nMO2+nLi+
【解析】
红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)粉碎后用硫酸浸取,Ni、Fe、Mg元素进入溶液,滤渣1为不溶于稀硫酸的SiO2;过滤后向滤液中加入次氯酸钠将Fe2+氧化成Fe3+,然后加入碳酸钠并加热除去铁元素和部分硫酸根,得到滤渣2为NaFe3(SO4)2(OH)6;过滤后向滤液中加入NaF除去镁离子,得到滤渣3为MgF2;过滤后加入碳酸氢铵得到碳酸镍沉淀,将碳酸镍沉淀加稀硫酸溶解,再向溶液中加入NaOH得到Ni(OH)2。
(6)根据图中放电时Li+的流向可知,放电时b极为正极,a极为负极;充电时b极为阳极,a极为阴极。根据总反应,放电时Li元素被氧化,所以LinC6为负极,即a极材料为LinC6,b极材料为Li1-nMO2。
(1)滤渣1的成分为不溶于稀硫酸的SiO2;
(2)加入NaClO可以将Fe2+氧化成Fe3+,便于除去;
当NaClO足量时,溶液Fe元素以Fe3+的形式存在,不含Fe2+,所以只要证明溶液中没有Fe2+就可以说明NaClO足量;
a.由于溶液中存在Fe3+,所以滴加KSCN溶液溶液会显红色,再加氯水没有明显变化,无法检验Fe2+,故不选a;
b.Fe2+可以和K3[Fe(CN)6]溶液生成蓝色沉淀,故b合适;
c.加NaOH溶液会产生Fe(OH)3沉淀,即便有Fe2+,产生的Fe(OH)2沉淀也会被迅速氧化,而且Fe(OH)3沉淀的颜色会覆盖掉Fe(OH)2的颜色,所以无法通过NaOH溶液判断是否有Fe2+,故不选c;
综上所述选b;
(3)反应物有Fe3+、Na2CO3、SO![]() 等,产物有NaFe3(SO4)2(OH)6,产物中的OHˉ说明该反应过程有Fe3+与CO
等,产物有NaFe3(SO4)2(OH)6,产物中的OHˉ说明该反应过程有Fe3+与CO![]() 的双水解,所以产物应该还有CO2,根据元素守恒可得离子方程式为Na++3Fe3++2SO
的双水解,所以产物应该还有CO2,根据元素守恒可得离子方程式为Na++3Fe3++2SO![]() +3H2O+3CO
+3H2O+3CO![]() =NaFe3(SO4)2(OH)6↓+3CO2↑;
=NaFe3(SO4)2(OH)6↓+3CO2↑;
(4)F-与H+结合形成弱电解质HF,MgF2Mg2++2F-平衡向右移动,导致镁离子沉淀不完全;
(5)沉镍时反应有Ni2+、NH4HCO3,产物有NiCO3说明不是双水解,而是Ni2+与HCO![]() 电离出的CO
电离出的CO![]() 结合生成NiCO3沉淀,促进HCO
结合生成NiCO3沉淀,促进HCO![]() 的电离,同时产生大量的氢离子,而氢离子又和HCO
的电离,同时产生大量的氢离子,而氢离子又和HCO![]() 反应生成二氧化碳和水,所以离子方程式为Ni2++2HCO
反应生成二氧化碳和水,所以离子方程式为Ni2++2HCO![]() =NiCO3↓+CO2↑+H2O;
=NiCO3↓+CO2↑+H2O;
(6)充电时b极为阳极,LiMO2失电子发生氧化反应,产生Li+,根据总反应可知电极反应式为LiMO2-ne-=Li1-nMO2+nLi+。

【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(1)反应②是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在____(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___v(逆)(填“>”、“=”或“<”)。
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A. B.
B. C.
C.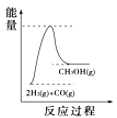 D.
D.
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应的离子方程式是____,实验中预计通过观察什么现象或测定什么数据来进行判断:_____。
(2)该实验的目的是____。
(3)实验③中的Vx=____;实验①和④测得反应速率分别为v1、v4,则v1____v4(填:“>”“<”和“=”)
(4)实验①中,c(Mn2+)与t关系如图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,猜想还可能是_____,利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是_______。