��Ŀ����
����Ŀ��������߷��ӻ�����F����������������Ժ����õ���ѧ���ܶ��õ��㷺��Ӧ�ã��ϳ�·�����£�

��֪:
�ش���������:
(1)A�к��еĺ��������ŵĵ���ʽΪ_______��A��B�ķ�Ӧ����Ϊ_____��
(2)E��һ�������»����Ժϳɺ�����Ԫ��״�ṹ��G����G�Ľṹ��ʽΪ_________��
(3)D��Eת����Ӧ�ٵĻ�ѧ����ʽ��_______��
(4)E����F��Ӧ�Ļ�ѧ����ʽ��______��
(5)��F��ƽ����Է�������Ϊ25890������ƽ���ۺ϶�Ϊ______ ��
(6)��������������C��ͬ���칹����____��(�����������칹)��
�ٺ���1����Ԫ̼�����һ�������4��̼ԭ���ϸ�����һ��ȡ���� ��1mol�����������Ƶ�Cu(OH)2����Һ��Ӧ����2molש��ɫ����
(7)д����![]() Ϊԭ��(�����Լ���ѡ)�Ʊ�������
Ϊԭ��(�����Լ���ѡ)�Ʊ������� �ĺϳ�·��______��
�ĺϳ�·��______��
���𰸡�![]() ������Ӧ
������Ӧ 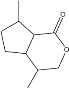
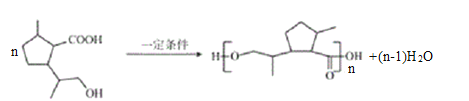 154 12
154 12 
��������
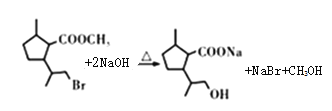
����B��C���Լ��������Լ�C�Ľṹ��ʽ����֪������������Ӧ�����Ƶõ�B�Ľṹ��ʽΪ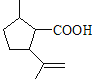 �����������֪C��HBr�ڹ������������·����ӳɷ�Ӧ����D�Ľṹ��ʽΪ
�����������֪C��HBr�ڹ������������·����ӳɷ�Ӧ����D�Ľṹ��ʽΪ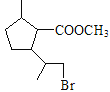 ��D��NaOHˮ��Һ����ˮ�⣬���ữ������E�Ľṹ��ʽΪ
��D��NaOHˮ��Һ����ˮ�⣬���ữ������E�Ľṹ��ʽΪ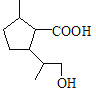 ��E�к����Ȼ����ǻ����������۷�Ӧ���ɾ�����߷��ӻ�����F��F�Ľṹ��ʽΪ
��E�к����Ȼ����ǻ����������۷�Ӧ���ɾ�����߷��ӻ�����F��F�Ľṹ��ʽΪ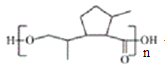 ��
��
(1)A�к��еĺ���������Ϊȩ��������ʽΪ![]() �� A(
�� A(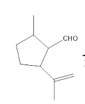 )��B��
)��B�� ����ת���������л���Ľṹ��ʽ��A�е�ȩ��������ΪΪ�Ȼ�����A��B�ķ�Ӧ����Ϊ������Ӧ��
����ת���������л���Ľṹ��ʽ��A�е�ȩ��������ΪΪ�Ȼ�����A��B�ķ�Ӧ����Ϊ������Ӧ��
(2)EΪ ����һ�������»����Ժϳɺ�����Ԫ��״�ṹ��G��������ڵ��ǻ����Ȼ�����������Ӧ���ɻ�״����G�Ľṹ��ʽΪ
����һ�������»����Ժϳɺ�����Ԫ��״�ṹ��G��������ڵ��ǻ����Ȼ�����������Ӧ���ɻ�״����G�Ľṹ��ʽΪ ��
��
(3)DΪ ת��ΪE
ת��ΪE ��ת����Ӧ�ٷ���������ԭ���ڼ���������ˮ�������ǻ������ڼ��������µ�ˮ�������Σ���ѧ����ʽ��
��ת����Ӧ�ٷ���������ԭ���ڼ���������ˮ�������ǻ������ڼ��������µ�ˮ�������Σ���ѧ����ʽ�� ��
��
(4) E�к����Ȼ����ǻ����������۷�Ӧ���ɾ�����߷��ӻ�����F ����Ӧ�Ļ�ѧ����ʽ�� ��
��
(5)Fд��H(C10H16O2)nOH,����ƽ����Է�������Ϊ25890������168n+18=25890����n=154���ۺ϶�Ϊ154��
(6) CΪ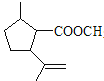 �������Ͷ�Ϊ3������ʽΪC11H18O2����1mol�����������Ƶ�Cu(OH)2����Һ��Ӧ����2molש��ɫ������˵����������ȩ��������1����Ԫ̼����˵����������̼ԭ�ӣ��һ�������4 ��̼ԭ���ϸ�����һ��ȡ������������̼��������������������������C��ͬ���칹���У�
�������Ͷ�Ϊ3������ʽΪC11H18O2����1mol�����������Ƶ�Cu(OH)2����Һ��Ӧ����2molש��ɫ������˵����������ȩ��������1����Ԫ̼����˵����������̼ԭ�ӣ��һ�������4 ��̼ԭ���ϸ�����һ��ȡ������������̼��������������������������C��ͬ���칹���У�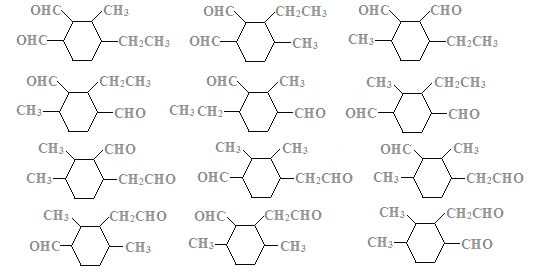 ��12�֣�
��12�֣�
(7) 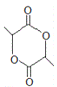 �й�����Ϊ������
�й�����Ϊ������ ��
��![]() ͨ��������Ӧ���ɣ�
ͨ��������Ӧ���ɣ�![]() ��ԭ��
��ԭ��![]() �Աȣ�ԭ����ȩ������Ϊ�Ȼ���̼̼˫�����ձ�Ϊ�ǻ���ģ��A��B��
�Աȣ�ԭ����ȩ������Ϊ�Ȼ���̼̼˫�����ձ�Ϊ�ǻ���ģ��A��B��![]() ������
������![]() ��������֪������
��������֪������![]() ��HBr�����ӳɷ�Ӧ����
��HBr�����ӳɷ�Ӧ����![]() ��
��![]() ˮ����ữ����
ˮ����ữ����![]() ���ϳ�·��Ϊ��
���ϳ�·��Ϊ��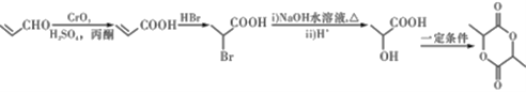 ��
��

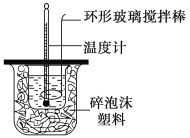
����Ŀ��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������Ͳ��ȡ50 mL 0.50 mol��L��1���ᵹ��С�ձ��У���������¶ȣ�������һ��Ͳ��ȡ50 mL 0.55 mol��L��1NaOH��Һ��������һ�¶ȼƲ�����¶ȣ��۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ�¶ȡ�
�ش��������⣺
��1������NaOH��Һ����ȷ������________(�����)��
A���ز������������롡 B���������������� C��һ��Ѹ�ٵ���
��2��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________(�����)��
A�����¶ȼ�С�Ľ���
B���ҿ���ĭ���ϰ��ò���������
C����������ձ�
D���������¶ȼ��ϵĻ��β����������������½���
��3���ֽ�һ������ϡ����������Һ��ϡ����������Һ��ϡ��ˮ�ֱ��1 L 1 mol��L��1��ϡ����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3����H1����H2����H3�Ĵ�С��ϵΪ__________________��
��4���������������������Һ���ܶȶ���1 g��cm��3����֪�кͷ�Ӧ��������Һ�ı�����c��4.18 J��g��1������1��Ϊ�˼����к��ȣ�ijѧ����¼�������£�
ʵ����� | ��ʼ�¶�t1/ �� | ��ֹ�¶�t2/ �� | |
���� | ����������Һ | �����Һ | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к��Ȧ�H��________(�������һλС��)��
��5��________(��ܡ����ܡ�)��Ba(OH)2��Һ�������������������Һ�����ᣬ������____________________________________________________��
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�������û�ѧ��Ӧԭ���о�̼��������ĵ��ʼ��仯����ķ�Ӧ�Թ�ҵ�������������Ⱦ�������ԴΣ���Ⱦ�����Ҫ���塣
(1)��֪����C(s)+O2(g)=CO2(g) ��H1=-393��5kJ/mol
��C(s)+CO2(g)=2CO(g) ��H2=+172��5kJ/mol
��4Fe(s)+3O2(g)=2Fe2O3(s) ��H3=-1651��0kJ/mol
CO��ԭ���������Ȼ�ѧ����ʽΪ_____________��
(2)�����ᡢ̼���Ϊ��Ԫ���ᣬ�䳣���µĵ��볣�����±���
H2CO3 | H2S | |
Ka1 | 4.410-7 | 1.310-7 |
Ka2 | 4.710-11 | 7.110-15 |
��ú�����������в������к�����H2S����������Na2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽΪ_______��
�ڳ����£�0.1mol��L-1 NaHCO3��Һ��0.1mol��L-1 NaHS��Һ��pH��ȣ�pH��С��Ϊ________ ��Һ(�ѧʽ)��
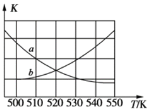
(3)һ�������£���ij�����ܱ������г���x mol CO2��y mol H2��������Ӧ��CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H (�˷�Ӧ�ڵ���ʱΪ�Է���Ӧ)��
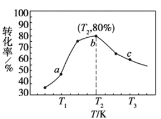
����ͼ�ܱ�ʾ�÷�Ӧ��ƽ�ⳣ��K���¶�T֮��ı仯��ϵ����Ϊ_____(����a������b��)�����ж�������__________��
����x=2��y=3���������ͬʱ���ڲ�ͬ�¶���H2��ת��������ͼ��ʾ�����ڸ�ʱ����ڣ�ǡ�ôﵽ��ѧƽ��ʱ����ʱ�����ڵ�ѹǿ�뷴Ӧ��ʼʱ��ѹǿ֮��Ϊ_____________��
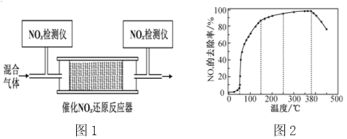
(4)�����������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2��
��NH3��NO2����N2�ķ�Ӧ�У�������28g N2ʱ��ת�Ƶĵ�����Ϊ____mol(���������λ��Ч����)��
�ڽ�һ��������O2��NH3��NOx�Ļ�����壬����ͨ��װ�д���M�ķ�Ӧ���з�Ӧ(װ����ͼ1)����Ӧ��ͬʱ��NOx��ȥ�����淴Ӧ�¶ȵı仯������ͼ2��ʾ����50��250 �淶Χ�������¶ȵ����ߣ�NOx��ȥ������Ѹ��������������������Ҫԭ����______������Ӧ�¶ȸ���380 ��ʱ��NOx��ȥ����Ѹ���½���ԭ�������____��
����Ŀ����������1mol��ѧ�������γ���̬ԭ������Ҫ��������![]() ��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
���ۼ� | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. �������ȶ��Ĺ��ۼ���H-F��
C. H2(g)��2H(g) ��H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) ��H=-25kJ/mol