题目内容
【题目】某学生用已知物质的量浓度的标准盐酸测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是___________。取用25.00mL待测液时需要的仪器是_____________。
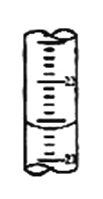
(2)滴定过程中,在锥形瓶底垫一张白纸的作用是_______________;若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图(上面数字:22,下面数字:23)。,则此时消耗标准溶液的体积为_________mL
(3)下列操作中可能使所测NaOH溶液的浓度数值偏高的是________。
A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
(4)用标准盐酸滴定上述待测NaOH溶液时,判定滴定终点的现象是:直到加入最后一滴盐酸,_____________________________为止。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
第二次 | 25.00 | 1.55 | 31.30 | 29.75 |
第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
计算该NaOH溶液的物质的量浓度:c(NaOH)=__________mol/L。(保留四位有效数字)
【答案】 500mL容量瓶 碱式滴定管 便于准确观察锥形瓶中溶液颜色变化 22.10 CD 溶液颜色由黄色变为橙色,且半分钟内不再变色 0.1050
【解析】(1)用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液;配制过程为:计算、称量、溶解、冷却、转移、洗涤、摇匀等,需要的仪器有托盘天平、烧杯、玻璃棒、量筒、![]() 容量瓶、胶头滴管,需用的玻璃仪器除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是
容量瓶、胶头滴管,需用的玻璃仪器除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是![]() 容量瓶;待测液为碱性,所以取用25.00mL待测液时需要的仪器是碱式滴定管;正确答案:500mL容量瓶;碱式滴定管。
容量瓶;待测液为碱性,所以取用25.00mL待测液时需要的仪器是碱式滴定管;正确答案:500mL容量瓶;碱式滴定管。
(2)滴定过程中,在锥形瓶底垫一张白纸的作用是便于准确观察锥形瓶中溶液颜色变化;滴定前滴定管内液面读数为0.50mL,滴定结束时读数为22.60 mL,则此时消耗标准溶液的体积为22.10 mL;正确答案:便于准确观察锥形瓶中溶液颜色变化;22.10。
(3)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=c(标准)×V(标准)/ V(待测)分析,c(待测)偏小,A错误;滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=c(标准)×V(标准)/ V(待测)分析,c(待测)无影响,B错误;酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测) =c(标准)×V(标准)/ V(待测)分析,c(待测)偏大,C正确;酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液的浓度偏小,造成V(标准)偏大,根据c(待测) =c(标准)×V(标准)/ V(待测)分析,c(待测)偏大,D正确;C、D符合题意,正确答案:C、D。
(4)甲基橙作指示剂,与碱液相遇,显黄色;随着酸液的滴入,溶液的碱性减弱,当加入最后一滴盐酸,混合液的颜色由黄色变为橙色,且半分钟内不再变色 ,达到滴定终点;正确答案:混合液的颜色由黄色变为橙色,且半分钟内不再变色。
(5)三次消耗的盐酸的体积分别为26.28mL、29.75 mL、26.22 mL,第二次数据误差过大,应该舍去,另外两次的平均值为![]() ,根据c(待测)=c(标准)×V(标准)/ V(待测)=0.1000×26.25×10-3/25×10-3=0.1050 mol/L;c(NaOH)= 0.1050 mol/L;正确答案:0.1050。
,根据c(待测)=c(标准)×V(标准)/ V(待测)=0.1000×26.25×10-3/25×10-3=0.1050 mol/L;c(NaOH)= 0.1050 mol/L;正确答案:0.1050。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_________________________________。
(2)该反应的正反应为____________反应(填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。此温度下加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为__________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L ,c(H2)为1.5mol/L,c(CO)为1mol/L, c(H2O)为3mol/L,则正、逆反应速率的比较为υ正________υ逆 。(填“>”、“<”或“=”)