题目内容
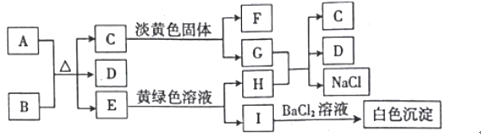
【题目】下列A~I九种中学化学常见的物质之间的转化关系如图所示,已知A为固态非金属单质,B在实验室常用作气体干燥剂,D为常见液体,常温下C、E、F都是无色气体,E能使酸性高锰酸钾溶液褪色,G是侯氏制碱法的最终产品。
(1)B的名称为________,图中淡黄色固体物质中的阴、阳离子个数比为_________。
(2)E转变为H和I的离子方程式是___________________,体现了E的_______性。
(3)E能使酸性高锰酸钾溶液褪色的离子方程式为______________________________。
【答案】浓硫酸 1:2 SO2+Cl2+2H2O=4H++SO42-+2Cl- 还原性 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
【解析】
根据图中各物质转化关系,A为固态非金属单质,B在实验室常用作气体干燥剂,常温下C、E、F都是无色气体,则A与B的反应为碳与浓酸硫的反应,E能与黄绿色溶液(应为氯水)反应,生成I遇氯化钡有白色沉淀,则I中应含有硫酸根,I为H2SO4,H为HCI,所以A为C,B为浓H2SO4,E为SO2,D为H2O,C是气体能与淡黄色固体反应,则应为二氧化碳与过氧化钠的反应,所以C为CO2,F为O2,G为Na2CO3,HCI与Na2CO3反应生成二氧化碳、氯化钠和水,符合各物质转化关系,据此答题.
(1)根据上述分析得B为浓H2SO4,B的名称为浓硫酸,题中淡黄色固体为过氧化钠,过氧化钠中阴阳离子个数比为1:2,本题答案为:浓硫酸;1:2;
(2)E(SO2)转变为H(HCI)和I(H2SO4)的离子方程式是:SO2+Cl2+2H2O=4H++2Cl-+SO42-,体现了E(SO2)的还原性,故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;还原性;
(3)E(SO2)能使酸性高锰酸钾溶液褪色的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,本题答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+

【题目】某学生用已知物质的量浓度的标准盐酸测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是___________。取用25.00mL待测液时需要的仪器是_____________。
(2)滴定过程中,在锥形瓶底垫一张白纸的作用是_______________;若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图(上面数字:22,下面数字:23)。,则此时消耗标准溶液的体积为_________mL

(3)下列操作中可能使所测NaOH溶液的浓度数值偏高的是________。
A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
(4)用标准盐酸滴定上述待测NaOH溶液时,判定滴定终点的现象是:直到加入最后一滴盐酸,_____________________________为止。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
第二次 | 25.00 | 1.55 | 31.30 | 29.75 |
第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
计算该NaOH溶液的物质的量浓度:c(NaOH)=__________mol/L。(保留四位有效数字)



