题目内容
【题目】I.(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①假设用酸性高锰酸钾溶液吸收煤燃烧产生的SO2,该过程中高锰酸根被还原为Mn2+,请写出该过程的离子方程式______________。
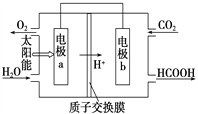
②将燃煤产生的二氧化碳加以回收,可降低碳的排放。左图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图,a电极名称:_____________(填“正极”或“负极”),b电极的反应式:________________________。
(2)如果采用NaClO、Ca(ClO)2作吸收剂,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___________。
②已知下列反应:
SO2(g)+2OH (aq) ==SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) = CaSO4(s) +H2O(l) +Cl (aq)的ΔH=_____。
II.(3)FeO![]() 在水溶液中的存在形态如图所示。
在水溶液中的存在形态如图所示。
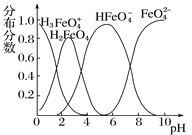
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO![]() 的分布分数的变化情况是__________。
的分布分数的变化情况是__________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,_________转化为_________(填微粒符号)。
【答案】 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ 负极 CO2+2e-+2H+=HCOOH 形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高 ΔH1+ΔH2-ΔH3 先增大后减小 HFeO![]() FeO
FeO![]()
【解析】I.(1)①酸性高锰酸钾溶液与SO2反应,高锰酸根被还原为Mn2+,SO2被氧化为硫酸根离子。
②原电池中,阳离子向正极移动,因此电极a为负极,电极b为正极。
(2)①次氯酸具有强氧化性,把SO2氧化为硫酸根离子,硫酸根离子与Ca2+形成CaSO4沉淀,促使Ca(ClO)2+2H2O![]() Ca(OH)2+2HClO平衡向产物方向移动,SO2转化率提高。
Ca(OH)2+2HClO平衡向产物方向移动,SO2转化率提高。
② 根据盖斯定律:计算ΔH。
II.(3)①根据图像可知,酸性增强,FeO![]() 的分布分数为先增大后减小。
的分布分数为先增大后减小。
②若向pH=6的这种溶液中,主要含有HFeO![]() ,逐滴加入KOH溶液,酸碱中和,HFeO
,逐滴加入KOH溶液,酸碱中和,HFeO![]() 不断减小,FeO
不断减小,FeO![]() 逐渐增多。
逐渐增多。
I.(1)①酸性高锰酸钾溶液吸收SO2,高锰酸根被还原为Mn2+,SO2被氧化为硫酸根离子,离子方程式:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ ;正确答案:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。
②原电池中,阳离子向正极移动;根据图示可知,氢离子向电极b移动,所以a电极为负极,b电极为正极,二氧化碳在此极发生还原反应,生成甲酸,b电极的反应式:CO2+2e-+2H+=HCOOH;正确答案:负极;CO2+2e-+2H+=HCOOH 。
(2)①Ca(ClO)2为强碱弱酸盐,发生水解:Ca(ClO)2+2H2O![]() Ca(OH)2+2HClO,次氯酸具有强氧化性,把SO2氧化为硫酸根离子,硫酸根离子与Ca2+形成CaSO4沉淀,平衡向产物方向移动,SO2转化率提高;正确答案:形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高。
Ca(OH)2+2HClO,次氯酸具有强氧化性,把SO2氧化为硫酸根离子,硫酸根离子与Ca2+形成CaSO4沉淀,平衡向产物方向移动,SO2转化率提高;正确答案:形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高。
② 根据盖斯定律:第一个反应+第二个反应-第三个反应,可得到SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) = CaSO4(s) +H2O(l) +Cl (aq),ΔH=ΔH1+ΔH2-ΔH3 ;正确答案ΔH1+ΔH2-ΔH3。
II.(3)①根据图像可知,若向pH=10的这种溶液中加硫酸至pH=2过程中,HFeO![]() 的分布分数为先增大后减小;正确答案:先增大后减小。
的分布分数为先增大后减小;正确答案:先增大后减小。
②若向pH=6的这种溶液中,主要含有HFeO![]() ,逐滴加入KOH溶液,酸碱中和,HFeO
,逐滴加入KOH溶液,酸碱中和,HFeO![]() 不断减小,FeO
不断减小,FeO![]() 逐渐增多,即HFeO
逐渐增多,即HFeO![]() 离子转化为FeO
离子转化为FeO![]() 离子;正确答案:HFeO
离子;正确答案:HFeO![]() ;FeO
;FeO![]() 。
。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |