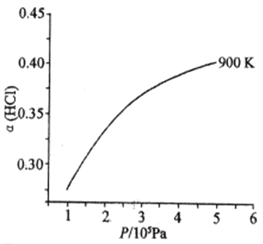
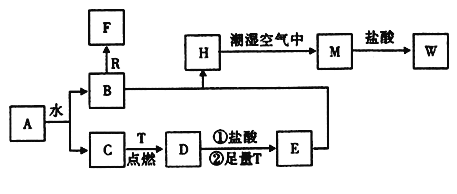
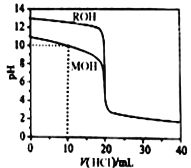
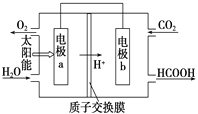
题目内容
【题目】实验室制备1-溴丁烷的原理为CH3CH2CH2CH2OH+NaBr+H2SO4![]() CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示(夹持装置已略去)
CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示(夹持装置已略去)
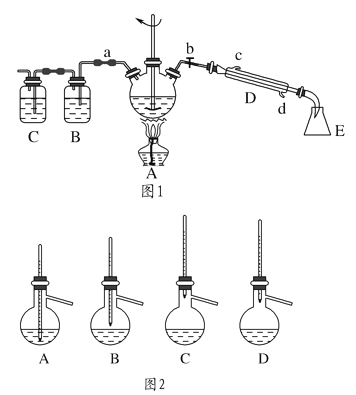
(1)仪器D的名称为________,使用玻璃棒搅拌的目的是__________________。
(2)1-溴丁烷的制备反应中可能有:________、________、溴化氢等副产物生成。熄灭图1中A装置中的酒精灯,打开a,余热会使反应继续进行。B、C装置可检验部分副产物,则B、C装置中所盛放的试剂分别是________、________。
(3)为了精制1-溴丁烷,待烧瓶冷却后,将A装置中的玻璃棒换成温度计,关闭a,打开b,使冷水从________(填“c”或“d”)处流入。对粗产品进行蒸馏提纯时,图2装置中温度计的位置正确的是________(填字母,下同),可能会导致收集到的产品中混有低沸点杂质的装置是________。
【答案】 直形冷凝管 使反应物混合均匀,充分反应,提高反应速率 丁醚 1-丁烯 硝酸银溶液或紫色石蕊溶液 溴水或酸性高锰酸钾溶液 d D AB
【解析】(1)根据装置图可知仪器D为直形冷凝管,三颈烧瓶中反应物要充分混合,需要用玻璃棒搅拌,同时搅拌可加快反应速率,所以玻璃棒的作用为使反应物混合均匀并充分反应,提高反应速率;
(2)CH3CH2CH2CH2OH在浓硫酸条件下加热可以生成1-丁烯或丁醚等,所以可能有的杂质为丁醚等,图1中B、C可分别用来检验反应产生的气态产物溴化氢、1-丁烯,B中装硝酸银溶液或紫色石蕊试液用来检验溴化氢,C装置中装入溴水或酸性高锰酸钾溶液用来检验1-丁烯;
(3)根据冷却时采用逆流,冷却效果较好,所以冷水应从d处流入,蒸馏是温度计的水银球位置应与蒸馏烧瓶支管口平齐,所以D装置正确,如果低于蒸馏烧瓶支管口,则会收集到低沸点的物质,所以AB装置符合题意。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Cu2+ Na+ |
阴离子 | NO3- SO42- Cl- |
下图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了32g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图2所示。据此回答下列问题:
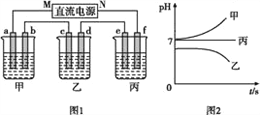
(1)M为电源的__________极(填“正”或“负”);
(2)写出甲烧杯中反应的化学方程式____________________;
(3)计算电极f上生成的气体在标准状况下的体积_____________。