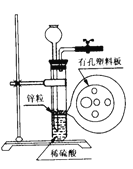
题目内容
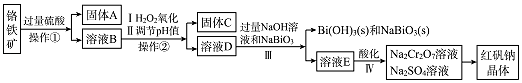
【题目】某粗铜含铁、金和铅等杂质,通过电解精炼铜后,阳极泥含有Cu、Au(金)和PbSO4等杂质,为充分利用电解后的阳极泥和电解液,设计如下工艺流程: 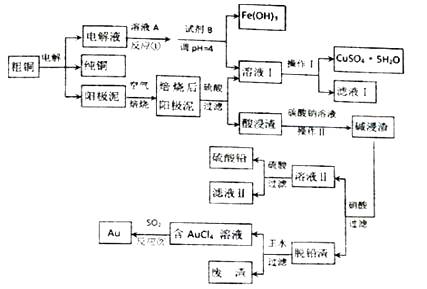
回答下列问题:
(1)溶液A是一种绿色氧化剂,则反应①的离子方程式为 .
(2)试剂B为 .
(3)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是(写一点即可).
(4)操作Ⅰ的主要步骤为过滤,洗涤,干燥
(5)写出反应②的离子方程式 .
(6)为了减少废液排放、充分利用有用资源,工业上将滤液Ⅰ并入溶液Ⅰ进行循环操作,请指出流程图中另一处类似的做法 .
(7)已知298K时,Ksp(PbCO3)=1.46×10﹣13 , Ksp(PbSO4)=1.2×10﹣8 , 用离子方程式表示加入碳酸钠溶液的作用 .
【答案】
(1)2Fe2++H2O2+2H+=2Fe3++2H2O
(2)CuO或Cu(OH)2或CuCO3
(3)将阳极泥粉碎,逆流焙烧等
(4)蒸发浓缩,降温结晶
(5)2AuCl4﹣+3SO2+6H2O=2Au+3SO42﹣+8Cl﹣+12H+
(6)用滤液Ⅱ溶解碱浸渣(或并入硝酸中)
(7)PbSO4(s)+CO32﹣(aq)?PbCO3(s)+SO42﹣(aq)
【解析】解:粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤(或继续)洗涤,干燥获得硫酸铜晶体;Au(金)和PbSO4等杂质经王水、浓硝酸氧化后可以得到硝酸铅以及含有AuCl4﹣+的物质,硝酸铅中加入硫酸可以转化为硫酸铅,AuCl4﹣可以被SO2还原得到Au.(1)反应①为亚铁离子被双氧水氧化成铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;(2)试剂B目的是调节溶液的PH值,同时不能引入新杂质,可以用CuO或Cu(OH)2或CuCO3 ,
所以答案是:CuO或Cu(OH)2或CuCO3;(3)要使焙烧效率提高,合理措施是把得到的阳极泥充分的粉碎,增大接触面积,或把反应后的气体在次逆流焙烧,这样可以升高温度且减少能耗,
所以答案是:将阳极泥粉碎,逆流焙烧等;(4)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,
所以答案是:蒸发浓缩,降温结晶;(5)SO2还原AuCl4﹣中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42﹣ , 还原产物是Au,根据氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,因此得到的反应方程式为:2AuCl4﹣+3SO2+6H2O=2Au+3SO42﹣+8Cl﹣+12H+;
所以答案是:2AuCl4﹣+3SO2+6H2O=2Au+3SO42﹣+8Cl﹣+12H+;(6)滤液Ⅰ是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,因此类似此处的做法,应该是流程中得到的另一滤液Ⅱ,此滤液Ⅱ是在硝酸铅溶液中加入硫酸生成硫酸铅沉淀并过滤走硫酸铅后剩下的溶液,此溶液中H+没有发生反应,因此还有大量的硝酸溶液,所以可以把此滤液当成硝酸加入前面的碱浸渣中溶解碱浸渣,或者与前面碱浸渣步骤需要加入的硝酸合并加以利用,所以答案是:用滤液Ⅱ溶解碱浸渣(或并入硝酸中);(7)通过比较两种沉淀的溶度积,可以看出碳酸铅比硫酸铅更加难溶,因此往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应,离子方程式要注意标明状态,方程式为:PbSO4(s)+CO32﹣(aq)PbCO3(s)+SO42﹣(aq).
所以答案是:PbSO4(s)+CO32﹣(aq)PbCO3(s)+SO42﹣(aq).