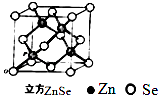
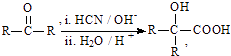题目内容
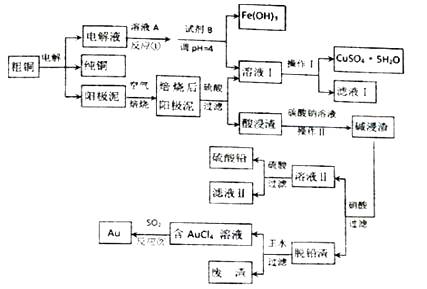
【题目】工业上以铬铁矿(主要成份为FeO.Cr2O3 , 还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠晶体(Na2Cr2O7 . 2H2O),其主要工艺流程如图: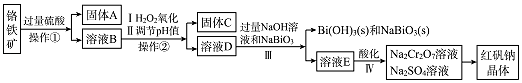
已知:NaBiO3在碱性条件下能将Cr3+氧化为CrO42﹣ .
(1)固体A为
(2)实验室中操作①②的名称为
(3)固体C中含有的物质是Al( OH)3和Fe(OH)3 , 则H2 O2的作用是 .
已知:KsP[Fe(OH)3]=3.0×10﹣39 , KsP[Al(OH)3]=1×10﹣33 , 当pH=5.6时Cr(OH)3开始沉淀.室温下,Ⅱ中需调节溶液pH范围为(杂质离子浓度小于1×10﹣6mol/L视为沉淀完全).
(4)写出Ⅲ中发生反应的离子方程式 .
(5)Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是(结合化学方程式回答);工业上也可设计如图示装置,用锂离子电池(LixC+Li1﹣xCoO2 ![]() C+LioO2 , LixC为难电离锂碳化合物)为电源,电解Na2CrO4溶液制取Na2Cr2O7 , 该装置工作时E电极的名称是极;电源的A极的电极反应式为 . 当电解过程中转移了0.5mol电子时,理论上右侧溶液的质量减少 g.
C+LioO2 , LixC为难电离锂碳化合物)为电源,电解Na2CrO4溶液制取Na2Cr2O7 , 该装置工作时E电极的名称是极;电源的A极的电极反应式为 . 当电解过程中转移了0.5mol电子时,理论上右侧溶液的质量减少 g.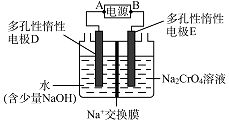
【答案】
(1)SiO2
(2)过滤
(3)氧化Fe2+ , 使铁元素完全转化成沉淀而除去;5.0<pH<5.6
(4)3NaBiO3+2Cr3++7OH﹣+H2O=2CrO42﹣+3Na++3Bi(OH)3
(5)2CrO42﹣+16H++6Cl﹣=2Cr3++3Cl2↑+8H2O;阳;LixC﹣xe﹣=C+xLi+;15.5
【解析】解:(1)根据以上分析,固体A为SiO2 , 所以答案是:SiO2;(2)根据以上分析,实验室中操作①②的名称为过滤,所以答案是:过滤;(3)固体C中含有的物质是Al( OH)3和Fe(OH)3 , 则H2 02的作用是氧化Fe2+ , 使铁元素完全转化成沉淀而除去;
当pH=5.6时Cr(OH)3开始沉淀,室温下,除去Cr3+溶液中的Fe3+、Al3+ , 氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10﹣33=c(Al3+)×c3(OH﹣),c(Al3+)=1×10﹣6molL﹣1 , 解得:c(OH﹣)=1×10﹣9molL﹣1 , c(H+)=1×10﹣5molL﹣1pH=5,同理Fe(OH)3完全变成沉淀时,pH约为3.5,故pH范围是:5.0<pH<5.6;所以答案是:氧化Fe2+ , 使铁元素完全转化成沉淀而除去;5.0<pH<5.6;(4)在溶液D中加入NaBiO3和NaOH,发生氧化还原反应,生成Bi(OH)3和CrO42﹣ , 所以Ⅲ中发生反应的离子方程式为3NaBiO3+2Cr3++7OH﹣+H2O=2CrO42﹣+3Na++3Bi(OH)3 ,
所以答案是:3NaBiO3+2Cr3++7OH﹣+H2O=2CrO42﹣+3Na++3Bi(OH)3;(5)Ⅳ中酸化是用硫酸而不用盐酸酸化,原因为CrO42﹣会氧化盐酸中的氯离子,反应离子方程式为:2CrO42﹣+16H++6Cl﹣=2Cr3++3Cl2↑+8H2O;
电解Na2CrO4溶液制取Na2Cr2O7 , 则E电极发生2CrO42﹣+2H+Cr2O72﹣+H2O,说明E电极生成氢离子,电极反应为氢氧根失电子发生氧化反应,所以该装置工作时E电极的名称是阳极,B极为正极,A极为负极,电极反应式为LixC﹣xe﹣=C+xLi+;当电解过程中转移了0.5mol电子时,则右侧反应消耗0.5mol氢氧根离子,放出 ![]() mol氧气,右侧移动到左侧的钠离子也为0.5mol,所以理论上右侧溶液的质量减少
mol氧气,右侧移动到左侧的钠离子也为0.5mol,所以理论上右侧溶液的质量减少 ![]() mol×32g/mol+0.5mol×23g/mol=15.5g,
mol×32g/mol+0.5mol×23g/mol=15.5g,
所以答案是:2CrO42﹣+16H++6Cl﹣=2Cr3++3Cl2↑+8H2O;阳;LixC﹣xe﹣=C+xLi+;15.5.