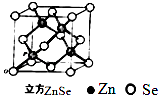
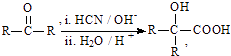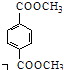��Ŀ����
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3���壬Fe��OH��3��������������ã�������ˮ�е������ʹ�������������ˮ�����ã���ԭ����ͼ��ʾ������˵����ȷ���ǣ� �� 
A.ʯī�缫�Ϸ���������Ӧ
B.����ͼʾ������AΪCO2
C.Ϊ��ǿ��ˮ�ĵ���������������ˮ�м��������Ҵ�
D.����ȼ�ϵ����CO32�������һ���ƶ�
���𰸡�B
���������⣺A��ʯīΪ�����������ĵ缫��ӦΪ��2H++2e��=H2��������ʯī�Ϸ�����ԭ��Ӧ����A����B�������������̼����Ϊ����ʣ�ͨ����缫Ϊ�����������缫��Ӧ��CH4+4CO32����8e��=5CO2+2H2O����Ӧ����CO2 �� ������ӦΪO2+2CO2+4e��=2CO32�� �� ��Ӧ����CO2 �� ��������AΪCO2 �� ��B��ȷ��
C��������Ҵ��Ƿǵ���ʣ�������ǿ�����ԣ���C����
D����������������ƶ���������CO32�������һ���ƶ�����D����
��ѡB��
��װ��Ϊ���أ���װ��Ϊԭ���װ�ã�ԭ��ع���ʱ��ͨ������һ��Ϊ����������������Ӧ�������缫��Ӧ��CH4+4CO32����8e��=5CO2+2H2O��ͨ��������һ��Ϊ������������ԭ��Ӧ��������ӦΪO2+2CO2+4e��=2CO32�� �� ������FeΪ����������Fe��2e��=Fe2+ �� ʯīΪ�����������ĵ缫��ӦΪ��2H++2e��=H2�����Դ˽����⣮

 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й����������
�����кϳɲ���ش����⣺
�� | �� | �屽 | |
�ܶ�/gcm��3 | 0.88 | 3.10 | 1.50 |
�е�/��C | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
��1����a�м���15mL��ˮ����������м����b��С�ļ���4.0mLҺ̬�壮��a�е��뼸���壬�а�ɫ��������������Ϊ���������壮�����μ���Һ����꣮װ��d��������
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӣ�NaOH��Һϴ�ӵ�������
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˣ������Ȼ��Ƶ�Ŀ������
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ����Ҫ��һ���ᴿ�����в����б��������������ȷѡ��ǰ����ĸ����
A.�ؽᾧ
B.����
C.����
D.��ȡ
��4���ڸ�ʵ���У�a���ݻ����ʺϵ�����������ȷѡ��ǰ����ĸ����
A.25mL B.50mL C.250mL D.500mL
��5��д��a�з�Ӧ����Ҫ�л���ѧ����ʽ