题目内容
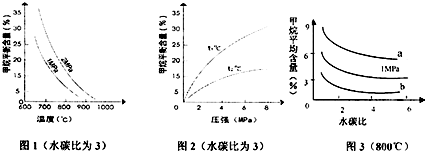
15.甲烷蒸汽反应为CHCH4(g)+H2O(g)?CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2.已知温度、压强和水碳比$(\frac{n({H}_{2}O)}{n(C{H}_{4})})$ 对甲烷蒸汽转化反应的影响如图
(1)该反应平衡常数K表达式为$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$.
(2)升高温度,平衡常数K增大(选填“增大”、“减小”或“不变”,下同),降低反应的水碳比,平衡常数K不变.
(3)图2中,两条曲线表示温度的关系是:t1<t2(选填“>”“=”或“<”),在图3中,当压强为2MPa时,CH4平衡含量与水碳比之间关系曲线应该是(选填“a”或“b”)a.
(4)工业生产中使用镍作催化剂.但要求原料中含硫量小于5×10-7%,其目的是防止催化剂中毒,失去催化效果.
分析 (1)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)根据图1分析,温度越高,甲烷越少,说明平衡正向移动;平衡常数仅与温度有关,据此分析;
(3)根据图1分析,温度越高,甲烷越少,图2分析,压强越高,甲烷越多,据此分析;
(4)工业生产中使用镍作催化剂.但要求原料中含硫量小于5×10-7%,防止催化剂中毒,失去催化效果.
解答 解:(1)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数k=$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$,故答案为:$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$;
(2)根据图1分析,温度越高,甲烷越少,说明平衡正向移动,则升高温度,平衡常数K增大,又平衡常数仅与温度有关,所以降低反应的水碳比,平衡常数K不变,故答案为:增大;不变;
(3)根据图1分析,温度越高,甲烷越少,所以t1<t2;图2分析,压强越高,甲烷越多,所以当压强为2MPa时,CH4平衡含量与水碳比之间关系曲线应该是a;故答案为:<;a;
(4)工业生产中使用镍作催化剂.但要求原料中含硫量小于5×10-7%,防止催化剂中毒,失去催化效果,故答案为:防止催化剂中毒,失去催化效果.
点评 本题考查了平衡常数的表达式的书写以及影响因素,图象分析,平衡常数概念的分析应用是解题关键,题目难度中等.

练习册系列答案
相关题目
6.标准状况下,1mol某种醇能与足量的钠反应生成22.4L氢气,则该醇可能是( )
| A. | CH3OH | B. | CH3CH2OH | C. | 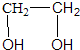 | D. | 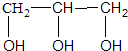 |
3.能正确表示下列反应的离子方程式是( )
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 锌片插入硝酸银溶液中Zn+Ag+═Zn2++Ag | |
| C. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+═BaSO4↓ |
10.下列有关表述正确的是( )
| A. | 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高正化合价一定是X<Y | |
| B. | 对于某元素的单质,若它的氧化性弱,那么它的还原性一定强 | |
| C. | 热稳定性:AsH3<PH3<H2O<HF | |
| D. | 最外层电子数较少的金属元素,一定比最外层电子数较多的金属元素活泼性强 |
20.某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置.请回答下列问题:
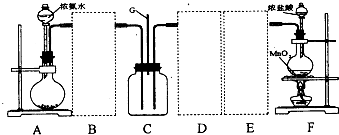
(1)装置A中烧瓶内的固体可选用ab.
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.BⅠ;DⅡ;EⅢ(填编号).装置I中需要的试剂是碱石灰.
(3)写出F中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子.
(5)该装置连接后尚存在的缺陷是:缺少尾气处理装置,污染环境.

| I | Ii | Iii | |
| 备选装置 | 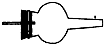 | 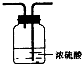 |  |
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.BⅠ;DⅡ;EⅢ(填编号).装置I中需要的试剂是碱石灰.
(3)写出F中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子.
(5)该装置连接后尚存在的缺陷是:缺少尾气处理装置,污染环境.
7.下列说法正确的是( )
| A. | 天然橡胶 和杜仲胶 和杜仲胶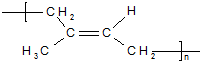 属于同分异构体 属于同分异构体 | |
| B. | 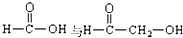 属于同系物 属于同系物 | |
| C. | 合成 的单体为乙烯和2-丁烯 的单体为乙烯和2-丁烯 | |
| D. | 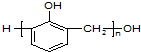 是由苯酚和甲醛发生加成反应后的产物脱水缩合而成 是由苯酚和甲醛发生加成反应后的产物脱水缩合而成 |
4.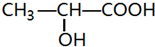 有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )
有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )
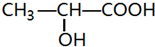 有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )
有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )| A. | 甲能与碳酸氢钠溶液发生反应 | |
| B. | 1mol甲能与2molNaOH反应 | |
| C. | 一定条件下,甲可发生酯化反应 | |
| D. | 由甲为原料制成高分子材料乙的反应不是加聚反应 |
5.2013年1月全国近二十个省区市遭遇雾霾天气,雾霾天气影响着人们的生活和生命安全.汽车排放的尾气是造成雾霾的因素之一.“减少污染源,削减大气污染物是解决雾霾的根本之道.”下列措施不能达到“减少污染源”目的是( )
| A. | 利用潮汐能电解水制氢气 | B. | 大力推广乙醇汽油燃料汽车 | ||
| C. | 利用甲烷制造燃料电池 | D. | 提倡化石燃料燃烧 |
 .
.