题目内容
10.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:| 物质 | 物理性质 | 化学性质 |
| 草酸(H2C2O4) | ①易溶于水 ②熔点189.5℃、100℃开始升华 ③草酸钙和草酸氢钙均是白色不溶物 | ①二元弱酸、酸性比碳酸强 ②有毒、具有腐蚀性 ③157℃左右分解、与浓硫酸混合会产生H2O、CO和CO2 |
| 草酸亚铁晶体(FeC2O4•2H2O) | ①浅黄色粉末状晶体 ②微溶于水,难溶于丙酮 | 受热易分解为氧化亚铁或铁单质 |
| 丙酮 | 与水互溶、易挥发 | ---- |
探究草酸的不稳定性.用下图中提供的仪器和试剂,验证草酸受热分解得到的混合气体中含有CO和CO2(加热装置和导管等在图中略去,部分装置可以重复使用).
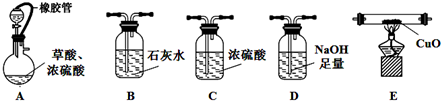
(1)仪器装置正确连接顺序为:ABDCEB.
(2)用上图入提供的装置和试剂实验时,在B中观察到有白色沉淀,也不能说明草酸分解有CO2,请提也改进意见在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
【实验Ⅱ】
实验室用硝酸氧化淀粉水解液法制备草酸.装置如下图所示,反应原理为:
C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
实验步骤如下:
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,蒸发浓缩、冷却结晶,抽滤后再重结晶得到草酸晶体
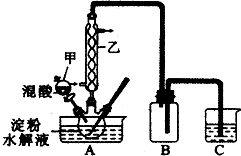
(3)上图实验装置中仪器乙的名称为:冷凝管、装置B的作用安全瓶,防止倒吸、C中试剂是NaOH溶液.
(4)检验淀粉是否水解完全的操作及现像是:取适量水解液于试管中,加入碘水,若溶液变蓝则淀粉水解完全,若溶液不变蓝则淀粉水解不完全.
【实验Ⅲ】
制备草酸亚铁晶体(FeC2O4•2H2O).反应原理为:
FeSO4•(NH4)2SO4•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O
实验步骤如下:
①称取13.7g FeSO4•(NH4)2SO4•6H2O放在200mL烧杯中,然后加30mL蒸馏水和2mL 2mol•L-1 H2SO4,加热溶解.
②再加入40mL 1mol•L-1草酸溶液,加热至沸,然后迅速搅拌(防止暴沸),待有黄色晶体析出后,停止加热,静置.
③弃去上层清液,用40mL蒸馏水充分洗涤晶体,过滤后,再用丙酮洗涤晶体并晾干得4.6g FeC2O4•2H2O
(5)生成的FeC2O4•2H2O需要充分洗涤,检验是否洗涤干净的操作及现像是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(6)用丙酮洗涤晶体的目的是减少草酸亚铁晶体的溶解,更快除去草酸亚铁晶体表面的水分.
(7)本实验FeC2O4•2H2O的产率为73.1%.
分析 (1)二氧化碳能使澄清的石灰水变浑浊,CO检验还原性,能还原黑色的CuO,生成的二氧化碳用澄清的石灰水检验,因为CO和CuO反应生成二氧化碳,所以应该先检验二氧化碳后检验CO;
(2)加热时草酸易挥发,草酸和氢氧化钙反应生成草酸氢钙沉淀;
(3)根据常见仪器的结构确定名称;反应生成的气体与C中氢氧化钠溶液反应,容易发生倒吸现象,装置B为安全瓶,起到了防止倒吸的作用;NO2和NO有毒,可用氢氧化钠溶液吸收;
(4)根据碘遇淀粉试液变蓝色来判断是否有淀粉;
(5)取最后一次洗涤液,检查是否含有硫酸根离子进行解答;
(6)根据FeC2O4•2H2O微溶于水,难溶于丙酮来解答;
(7)根据FeSO4•(NH4)2SO4•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O计算求出FeC2O4•2H2O的理论值,最后求出产率.
解答 解:(1)为证明草酸的受热分解产物中含有CO2和CO,先将混合气体通入澄清的石灰水检验CO2,如果澄清的石灰水变浑浊,则证明含有CO2气体,再用NaOH溶液吸收CO2,再将洗气后的气体进行干燥,然后将气体再通过黑色的CuO装置,CO和黑色的CuO反应生成Cu和CO2,再用澄清的石灰水检验CO2是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有CO,所以其排列顺序是ABDCEB;
故答案为:ABDCEB;
(2)草酸加热100℃开始升华,157℃时开始分解,草酸钙和草酸氢钙均为白色不溶物,加热时草酸易挥发,生成的碳氧化物中含有草酸,草酸和氢氧化钙反应生成草酸氢钙沉淀,从而干扰实验现象,为防止干扰实验,在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管),
故答案为:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管);
(3)仪器乙的名称为是冷凝管;反应中生成的NO2、NO能够与氢氧化钠溶液反应生成亚硝酸钠,容易发生倒吸现象,装置B为安全瓶;
故答案为:冷凝管;安全瓶,防止倒吸;NaOH溶液;
(2)碘遇淀粉试液变蓝色,取适量水解液于试管中,加入碘水,若溶液变蓝则淀粉水解完全,若溶液不变蓝则淀粉水解不完全;
故答案为:取适量水解液于试管中,加入碘水,若溶液变蓝则淀粉水解完全,若溶液不变蓝则淀粉水解不完全;
(5)取最后一次洗涤液,检查是否含有硫酸根离子,具体操作:用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净;
故答案为:用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净;
(6)由于FeC2O4•2H2O微溶于水,难溶于丙酮,所以用丙酮洗涤晶体的目的是减少草酸亚铁晶体的溶解,更快除去草酸亚铁晶体表面的水分;
故答案为:减少草酸亚铁晶体的溶解,更快除去草酸亚铁晶体表面的水分;
(7)13.7g FeSO4•(NH4)2SO4•6H2O的物质的量为$\frac{13.7g}{392g/mol}$=0.03494mol,40mL 1mol•L-1草酸溶液中草酸的物质的量为0.04L×1mol•L-1=0.04mol,草酸过量,
FeSO4•(NH4)2SO4•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O
1 1
0.03494mol 0.03494mol
FeC2O4•2H2O的质量为0.03494mol×180g/mol=6.29g,FeC2O4•2H2O的产率为$\frac{4.6g}{6.29g}$×100%=73.1%;
故答案为:73.1%.
点评 本题属于信息题,注意考查了物质的性质、检验、除杂等,综合性较强,但难度不是很大,关键是通过阅读众多的信息量提取有用的信息结合已有的相关知识进行解析即可.

| A. | 金刚石、石墨的混合物 | B. | 冰、水混合物 | ||
| C. | 氨水 | D. | 盐酸 |
| A. | HCI和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ?mol-1 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| A. | 可以用分液漏斗分离硝基苯和苯 | |
| B. | 加浓溴水,然后过滤可以除去苯中少量乙烯 | |
| C. | 苯、溴水、铁粉混合制得溴苯 | |
| D. | 用溴水可以鉴别苯、乙醇、苯乙烯( ) ) |
| A. | 乙酸乙酯、甲苯、十一烷 | B. | 乙醇、苯、庚烯 | ||
| C. | 甘油、甲醛、硝基苯 | D. | 溴苯、四氯化碳、苯磺酸钠 |
| I | Ii | Iii | |
| 备选装置 |  | 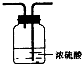 |  |
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
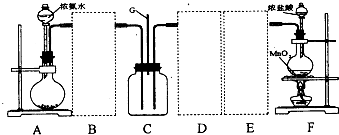
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.BⅠ;DⅡ;EⅢ(填编号).装置I中需要的试剂是碱石灰.
(3)写出F中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子.
(5)该装置连接后尚存在的缺陷是:缺少尾气处理装置,污染环境.
 .
.
 ,反应类型:取代反应.
,反应类型:取代反应.