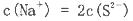题目内容
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0molL-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
C
解析试题分析:A、pH=4的醋酸中:c(H+)=10—4mol·L-1,错误;B、根据物料守恒知,饱和小苏打溶液中:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),错误;C、根据电荷守恒知,饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-),正确;D、50℃时Kw>1×10-14,pH=12的纯碱溶液中:c(OH-)>1.0×10-2mol?L-1,错误。
考点:考查pH计算、溶液中离子浓度大小关系。

练习册系列答案
相关题目
NH4Cl溶液中的离子浓度大小关系正确的是
A. | B. |
C.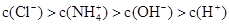 | D. |
下列溶液中各微粒的浓度关系正确的是
| A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液, c (NH4+)的大小顺序为:①>②>③ |
| B.pH相等的NaF与CH3COOK溶液:c(Na+)-c(F —)>c(K+)-c(CH3COO—) |
| C.0.2 mo1·L —1的Na2CO3溶液:c(OH—)=c(HCO3—)+c(H+)+2c(H2CO3) |
D.0.2 mo1·L —1 HCl与0.1 mo1·L —1 NaAlO2溶N液等体积混合: c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
| D.FeS + 2H+= Fe2+ + H2S↑ |
在100mL0.1mol/L醋酸溶液中加入以下物质中的一种,醋酸溶液pH变小。所加入的这种物质是
| A.水 | B.0.1mol/L盐酸 |
| C.醋酸钠晶体 | D.0.1mol/L氢氧化钠溶液 |
25℃时,满足c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是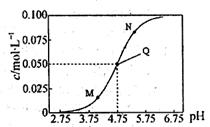
| A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l |
| B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 |
| C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。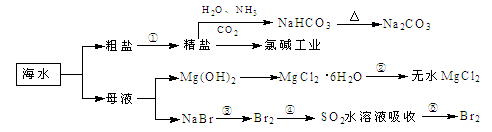
下列有关说法正确的是
| A.过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |