题目内容
下列说法中正确的是
| A.0. 1mol/L (NH4)2SO4溶液中:c(SO42—)<c(NH4+) |
| B.相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH—)之比是2:1 |
| C.向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3—) |
| D.常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO—) |
AC
解析试题分析:A.由化学式(NH4)2SO4及水解是微弱的可知,此项正确;B.氨水的浓度是2:1,但是电离程度却是浓度越大,反而越小,错误;C.由于NaNO3强酸强碱盐,PH=7,c(Na+)=c(NO3—)当加入了HNO3后,c(Na+)<c(NO3—) ,此项正确;D.根据电荷守恒,c(H+)+c(Na+)=c(CH3COO—)+c(OH—)及PH=7时c(H+)=c(OH—)可知,c(Na+)=c(CH3COO—) ,错误。
考点:盐类水解的一般特点,弱电解质的电离特点,混合溶液中的电荷守恒.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
下列溶液中各微粒的浓度关系正确的是
| A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液, c (NH4+)的大小顺序为:①>②>③ |
| B.pH相等的NaF与CH3COOK溶液:c(Na+)-c(F —)>c(K+)-c(CH3COO—) |
| C.0.2 mo1·L —1的Na2CO3溶液:c(OH—)=c(HCO3—)+c(H+)+2c(H2CO3) |
D.0.2 mo1·L —1 HCl与0.1 mo1·L —1 NaAlO2溶N液等体积混合: c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) |
25℃时,满足c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是
| A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l |
| B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 |
| C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列有关说法正确的是
| A.过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
室温下,对pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,其中叙述正确的是
| A.温度升高20℃后,两溶液pH均不变 |
| B.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| C.加水稀释2倍后,两溶液的pH同等程度减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气一样多 |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )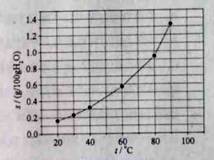
| A.溴酸银的溶解时放热过程 |
| B.温度升高时溴酸银溶解速度加快 |
| C.60 ℃时溴酸银的Ksp约等于6×10-4 |
| D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
室温下,下列溶液中粒子浓度大小关系正确的是
| A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
下列叙述不正确的是
| A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—) |
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<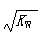 |
| C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体 |
| D.酸与碱完全中和,所得溶液的pH可能大于7 |