题目内容
已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与某浓度的Pb(NO3)2溶液按体积比为2:1混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为
D
解析试题分析:KI与Pb(NO3)2溶液按体积比为2:1混合,混合后溶液体积增加,碘离子物质的量浓度减小为原来的2/3,c(I-)=7.5×10-3 mol/L×2/3=5×10-3 mol/L;PbI2沉淀溶解平衡为:PbI2(s)?Pb2++2I-;c(Pb2+)×[c2(I-)]=Ksp所以c(Pb2+)= =2.8×10-4 mol/L,所以原Pb(NO3)2溶液中c(Pb2+)=2.8×10-4 mol/L×3=8.4×10-4 mol/L,D正确。
=2.8×10-4 mol/L,所以原Pb(NO3)2溶液中c(Pb2+)=2.8×10-4 mol/L×3=8.4×10-4 mol/L,D正确。
考点:考查溶度积的相关知识。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
下列过程表达式中,属于电离方程式的是
A.  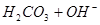 | B.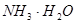   |
C. | D.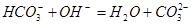 |
常温时,下列叙述正确的是
| A.pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B.pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍 |
| C.AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D.1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小 |
在100mL0.1mol/L醋酸溶液中加入以下物质中的一种,醋酸溶液pH变小。所加入的这种物质是
| A.水 | B.0.1mol/L盐酸 |
| C.醋酸钠晶体 | D.0.1mol/L氢氧化钠溶液 |
下列叙述正确的是
| A.c(H+)等于l×l0-7mol/L的溶液一定是中性溶液 |
| B.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其Kw= l×l0-14 |
| C.将水加热,Kw增大,pH不变 |
| D.任何浓度的溶液都可以用pH来表示其酸性的强弱 |
25℃时,满足c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是
| A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l |
| B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 |
| C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7 |
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸于,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液中缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
室温下,对pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,其中叙述正确的是
| A.温度升高20℃后,两溶液pH均不变 |
| B.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| C.加水稀释2倍后,两溶液的pH同等程度减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气一样多 |
下列各项说法中,不正确的是 ( )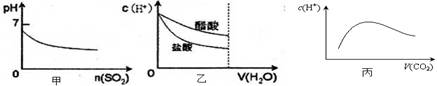
| A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图 |
| B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |