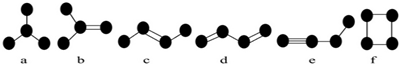
题目内容
13.下列实验操作、现象和结论均正确的是( )| 实验操作 | 现象 | 解释 | |
| A | 常温下,用pH计测定NaHCO3溶液的pH | pH=8.5 | HCO3-的水解程度大于电离程度 |
| B | 向一定量的浓硫酸中加入过量的锌粒,微热至反应结束 | 产生气泡 | 该气体成分仅为SO2 |
| C | 往盛有少量水的两支试管中分别加入Na和Na2O2 | 固体溶解,产生气泡 | 两个反应中水都作氧化剂 |
| D | 往滴有KSCN的FeCl2溶液中通入少量Cl2 | 溶液由浅绿色变血红色 | 氧化性:Cl2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.常温下pH>7,溶液显碱性;
B.浓硫酸中加入过量的锌粒,先发生氧化还原反应生成二氧化硫,后浓硫酸转化为稀硫酸,Zn与稀硫酸反应生成氢气;
C.Na与水反应生成氢气,水中H元素的化合价降低,而过氧化钠与水反应生成氧气,只有过氧化钠中O元素的化合价变化;
D.由现象可知,亚铁离子被氯气氧化.
解答 解:A.常温下pH>7,溶液显碱性,弱酸根离子水解显碱性,则HCO3-的水解程度大于电离程度,故A正确;
B.浓硫酸中加入过量的锌粒,先发生氧化还原反应生成二氧化硫,后浓硫酸转化为稀硫酸,Zn与稀硫酸反应生成氢气,则生成的气体为二氧化硫和氢气的混合物,故B错误;
C.Na与水反应生成氢气,水中H元素的化合价降低,而过氧化钠与水反应生成氧气,只有过氧化钠中O元素的化合价变化,则与过氧化钠的反应中水既不是氧化剂也不是还原剂,故C错误;
D.由现象可知,亚铁离子被氯气氧化,则氧化性:Cl2>Fe3+,故D正确;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,涉及盐类水解及应用、物质的性质及氧化还原反应等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
3.下列有关物质应用的说法正确的是( )
| A. | 玻璃容器可长期盛放各种酸 | B. | P2O5可用于干燥Cl2和NH3 | ||
| C. | Si和SiO2都用于制造光导纤维 | D. | Na2S可除去污水中的Cu2+ |
4.下列关于有机物莽草酸(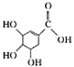 )和鞣酸(
)和鞣酸(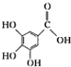 )的叙述中,正确的是( )
)的叙述中,正确的是( )
 )和鞣酸(
)和鞣酸( )的叙述中,正确的是( )
)的叙述中,正确的是( )| A. | 两种有机物中含有完全相同的官能团 | |
| B. | 两种酸都能与溴水反应,且反应类型相同 | |
| C. | 分别向两种酸中滴加三氯化铁溶液,均发生显色反应 | |
| D. | 等物质的量的两种酸与NaOH反应,消耗NaOH的量不同 |
1.化学与资源、环境、生活关系密切,下列说法不正确的是( )
| A. | 将镁块与钢铁输水管相连,可防止钢铁腐蚀 | |
| B. | 推广使用新能源,可以减少二氧化碳等温室气体的排放 | |
| C. | 焊锡中加铅的目的是降低熔点 | |
| D. | 石油是混合物,其分馏产品汽油为纯净物 |
8.短周期元素X、Y、Z、W的原子序数逐渐增大,其中X原子的电子数与电子层数相等,Z为短周期中金属性最强的元素,Y与X、Y与Z均能形成原子个数比为1:1和1:2的两种化合物,Y和W同主族.下列说法正确的是( )
| A. | Y与Z形成的两种化合物中所含化学键类型完全相同 | |
| B. | 化合物X2W比化合物X2Y稳定 | |
| C. | Y、Z、W三种元素形成的化合物的水溶液一定呈中性 | |
| D. | 原子半径:r(Z)>r(W)>r(Y)>r(X) |
18.“化学--我们的生活,我们的未来”.下列有关知识叙述正确的是( )
| A. | 氢气是未来的理想燃料 | B. | 苯酚不能用于杀菌消毒 | ||
| C. | 人体缺铁易引起甲状腺肿大 | D. | 乙醇是不可再生的生物质能源 |
3.下列微粒之间能形成离子键的是( )
①K+
②质量数为19,中子数为10的原子
③第三周期半径最大的原子(Ar除外)
④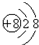
①K+
②质量数为19,中子数为10的原子
③第三周期半径最大的原子(Ar除外)
④
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
20.下列图示实验正确的是( )
| A. |  实验室制备氨气 | B. | 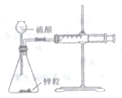 测量锌和硫酸反应的速率 | ||
| C. |  铁的吸氧腐蚀 | D. |  实验室制氧气 |