题目内容
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
(1)反应①为__________(选填“吸热”或“放热”)反应。
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。

 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。
(1)吸热 (2)1.00 mol·L-1 (3)B C(对一个计1分)
(4) Fe2O3(s)+CO(g)== 2FeO(s)+CO2(g) ΔH=(2a+b) kJ·mol-1
(5)4.0×10-8
(6)Zn - 2e-+2OH--== ZnO+H2O 5.60
(4) Fe2O3(s)+CO(g)== 2FeO(s)+CO2(g) ΔH=(2a+b) kJ·mol-1
(5)4.0×10-8
(6)Zn - 2e-+2OH--== ZnO+H2O 5.60
试题分析:(1)反应①平衡常数为K随温度的升高而增大,说明是吸热反应;
(2) 500℃时进行反应①的K=1,平衡时c(CO)=c(CO2);CO2的起始浓度为2 mol·L-1,CO的平衡浓度为1 mol·L-1。
(3)反应Fe(s)+CO2(g)

 FeO(s)+CO(g) ΔH<0,
FeO(s)+CO(g) ΔH<0,A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率也增大,不会减小,故不正确;
B. 在500 ℃下反应K=1,故当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,气体的物质的量不变,但CO生成CO2,质量增重,正向移动,当容器内气体密度不再变化时,反应达到平衡状态,正确;
D.加压和使用催化剂不会使平衡移动,故反应物的转化率不变,不正确。
(4)根据盖斯定律来写。
(5)pH=4时,c(OH-)=10-10mol·L-1,c(Fe3+)=
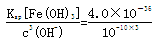 =4.0×10-6mol·L-1
=4.0×10-6mol·L-1(6)电池的负极是活泼金属Zn,注意碱性环境得出负极反应式:Zn-2e-+2OH-==ZnO+H2O,
根据电子得失2Cu——O2,6.4g铜需要0.05molO2,0.25mol(0.25 mol×22.4L/mol =5.60L)空气。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 O2(g)
O2(g) CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol


 个,左室溶液中
个,左室溶液中 的变化量为________________。
的变化量为________________。 CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol CO(g)
CO(g) Fe3O4(s)+
Fe3O4(s)+