题目内容
(9分)如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答:

(1)实验中观察到的现象是____________________。(选填代号)
(2)试管中发生的反应属于____________________(选填“氧化还原反应”或“非氧化还原反应”)。
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。

(1)实验中观察到的现象是____________________。(选填代号)
| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
A B D 氧化还原反应 Mg+2H+=Mg2++H2↑ 小于
试题分析:(1)当向试管中不断滴加HCl时,发生反应:Mg+2HCl=MgCl2+ H2↑;因此会看到试管中镁片逐渐溶解 ,同时有无色气泡产生,由于上述反应是放热反应,所以在试管的外壁会变热。而Ca(OH)2在水中的溶解度会随着温度的升高而降低,所以温度升高,Ca(OH)2溶解度减小,会析出Ca(OH)2产生固体。因此选项是A、B、D。(2)试管中发生的反应从基本类型看属于置换反应,由于在反应前后元素的化合价发生了变化,所以从反应实质看属于氧化还原反应。(3)有关反应的离子方程式是Mg+2H+=Mg2++H2↑;(4)由于该反应是放热反应,所以由实验推知,MgCl2溶液和H2的总能量小于反应物镁片和盐酸的总能量。

练习册系列答案
相关题目
 2NH3(g)(放热反应)。下列描述中正确的是
2NH3(g)(放热反应)。下列描述中正确的是


 其相关数据如下表所示:
其相关数据如下表所示:

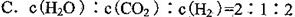


 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;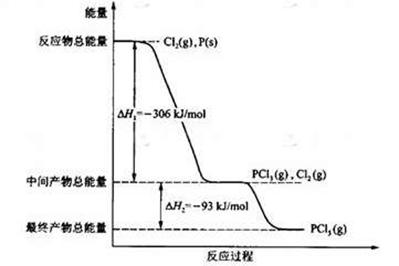
 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为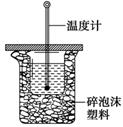

 的变化情况
的变化情况