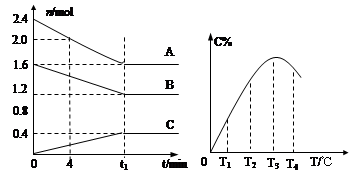题目内容
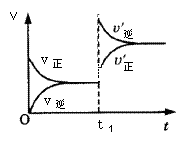
mA(s)+nB(g)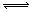 qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
甲 乙
| A.n<q | B.n>q |
| C.正反应为放热反应 | D.X点比Y点反应速率快 |
AC
解析试题分析:据图甲可知,增大压强,B物质的百分含量增大,反应向逆反应方向进行,即体积减小的方向进行,所以n<q所以A选项是正确的。乙图可知,增大温度,逆反应增大的程度比正反应方向的大,因此增大温度反应是向逆反应方向进行,即吸热方向。所以该反应为放热反应,因此C选项是正确的。D选项X的压强小于Y点,因此D选项是错误的。
考点:考查化学反应速率与化学平衡的相关知识点

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题: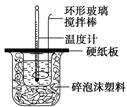
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热 (填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会 (填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会 (填“偏大”、“偏小”或“不变”),其原因是 。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH= 。根据计算结果,写出该中和反应的热化学方程式 。
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:① 2C(焦炭)+O2(空气)=2CO;② Fe2O3+3CO=2Fe+3CO该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是
| A.CO过量 | B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 | D.CO与Fe2O3的反应有一定限度 |
某温度下,在2L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。下列叙述错误的是 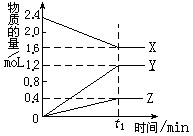
A.该反应的化学方程式是2X 3Y+Z 3Y+Z |
| B.在t1min时,该反应达到了平衡状态 |
| C.t1min时,X、Y、Z的反应速率相等 |
| D.当该反应已达到平衡状态时,每生成1molZ的同时生成2molX |
决定化学反应速率的主要因素是
| A.催化剂 | B.参加反应的物质本身的性质 |
| C.反应物的浓度 | D.温度、压强以及反应物的接触面 |
在温度不变的条件下,在恒容的容器中进行下列反应: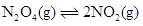 。若
。若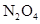 的浓度由
的浓度由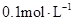 降到
降到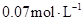 需要15s,那么
需要15s,那么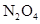 的浓度由
的浓度由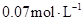 降到
降到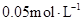 所需的反应时间( )
所需的反应时间( )
| A.等于5s | B.等于10s | C.大于10s | D.小于10s |
下图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)
| A.等于1.369 g·L-1 |
| B.等于2.054 g·L-1 |
| C.在1.369g·L-1和2.054g·L-1之间 |
| D.在2.054g·L-1和4.108g·L-1之间 |
 2SO3(g)的平衡常数为 。
2SO3(g)的平衡常数为 。