题目内容
汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)=2NO(g),导致汽车尾气中的NO和NO2对大气造成污染。
(1)在不同温度(T1,T2)下,一定量的NO分解产生N2和O2的过程中N2的体积分数随时间t变化如右图所示。根据图像判断反应N2(g)+O2(g)=2NO(g)为_________反应(填“吸热”或“放热”),随着温度的升高,该反应的平衡常数K________(填“增大”“减小”或“不变”,平衡向________移动(填“向左”“向右”或“不”)。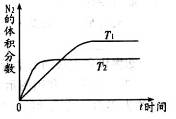
(2)某温度时,向容积为1L的密闭容器中充入5mol N2与2.5molO2,发生N2(g)+O2(g)=2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为_________,该温度下,反应的平衡常数K=________。该温度下,若开始时向上述容器中加入的N2与O2均为1mol,则N2的平衡浓度为_______mol/L。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示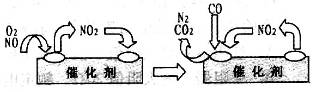 。
。
写出上述变化中的总化学反应方程式:________________________________________。
(4)用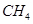 催化还原
催化还原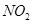 的方法也可以消除氮氧化物的污染。例如:
的方法也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
写出CH4还原NO2至N2的热化学方程式_______________________________________。
(14分)(1)吸热(2分);增大(1分);向右(1分)
(2)0.25mol/(L·min)(2分);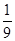 (2分);
(2分);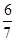 (2分)
(2分)
(3)2NO+O2+4CO 4CO2+N2(2分)
4CO2+N2(2分)
(4)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol(2分)
解析试题分析:(1)根据图象判断,T2曲线先到达平衡,因此反应速率大,温度较高。而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应;正方应吸热,因此随着温度的升高,平衡向正反应方向移动,即向右移动,所以该反应的平衡常数K增大。
(2) N2(g)+O2(g)=2NO(g)
起始浓度(mol/L) 5 2.5 0
转化浓度(mol/L) 0.5 0.5 1
平衡浓度(mol/L) 4.5 2.0 1
所以2min内氧气的平均反应速率为0.5mol/L÷2min=0.25mol/(L·min)
该温度下,反应的平衡常数K=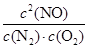 =
=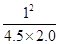 =
=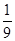
若开始时向上述容器中加入的N2与O2均为1mol,则
N2(g)+O2(g)=2NO(g)
起始浓度(mol/L) 1 1 0
转化浓度(mol/L) x x 2x
平衡浓度(mol/L) 1-x 1-x 2x
所以根据K=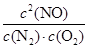 =
=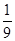 可知
可知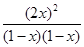 =
=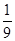
解得x=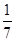
所以N2的平衡浓度为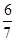 mol/L
mol/L
(3)NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,所以反应的化学方程式为2NO+O2+4CO 4CO2+N2。
4CO2+N2。
(4)根据反应①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol和反应②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol并依据盖斯定律可知,(①+②)÷2即得到反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),所以该反应的反应热△H=(-574kJ/mol-1160kJ/mol)÷2=-867kJ/mol。
考点:考查外界条件对平衡状态的影响;反应速率和平衡常数的有关计算;氧化还原反应方程式以及热化学方程式的书写等

已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。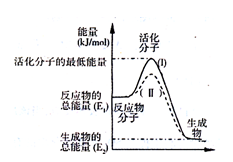
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
从表中数据分析,该实验的目的是 ;
表中显色时间t1= s;最终得出的结论是 。
甲烷和氨在国民经济中占有重要地位。
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
① 反应热ΔH(填“>”、“<”或“=”)_______0。
② 在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
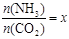 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。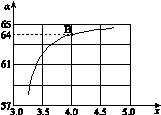
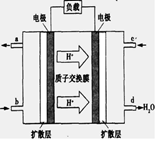
(3)已知甲烷燃料电池的工作原理如下图所示。该电池工作时,a口放出的物质为_________,该电池正极的电极反应式为:____ ,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有 mol 电子发生转移。
决定化学反应速率的主要因素是
| A.催化剂 | B.参加反应的物质本身的性质 |
| C.反应物的浓度 | D.温度、压强以及反应物的接触面 |
 2SO3(g)的平衡常数为 。
2SO3(g)的平衡常数为 。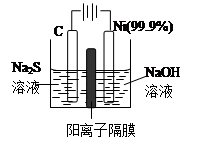
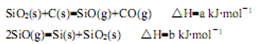
 Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;