题目内容
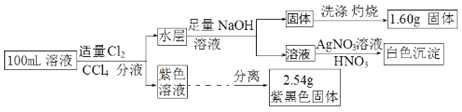
【题目】常温下,有pH=1的某溶液中可能有Na+、Fe3+、Fe2+、I﹣、Cl﹣、CO32﹣中的某几种,现取100mL该溶液进行如下实验:已知氧化性Fe3+>I2,根据实验结果,下列判断正确的是( )
A.Fe3+、I﹣、Cl﹣三种离子一定存在
B.不能确定Na+和Cl﹣是否存在,CO32﹣一定不存在
C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl﹣)≥0.3molL1
【答案】D
【解析】
pH=1的溶液中存在大量氢离子,则一定不存在CO32-;向溶液中通入氯气、加入CCl4分液后得到紫色溶液,则原溶液中含有I-,Fe3+能够氧化I-,则一定不存在Fe3+;水层中加入氢氧化钠溶液得到固体,该固体洗涤、灼烧得到的1.60g固体为氧化铁,则溶液中一定存在Fe2+,然后结合碘单质的质量、氧化铁的质量及电荷守恒判断氯离子的存在情况及浓度。
pH=1的溶液中氢离子浓度为0.1mol/L,100mL该溶液中含有氢离子的物质的量n(H+)=0.1mol/L×0.1L=0.01mol,由于H+与CO32-会发生离子反应,因此一定不存在CO32-;
向溶液中通入氯气、加入CCl4分液后得到紫色溶液,说明反应产生了I2,原溶液中含有I-,Fe3+能够氧化I-,则一定不存在Fe3+;2.54g紫黑色固体为碘单质,其物质的量n(I2)=2.54g÷254g/mol=0.01mol,则原溶液中含有碘离子的物质的量n(I-)=2n(I2)=0.02mol;
水层中加入NaOH溶液得到固体,该固体洗涤、灼烧得到的1.60g固体为Fe2O3,则溶液中一定存在Fe2+,根据铁元素守恒可知Fe2+的物质的量n(Fe2+)=2n(Fe2O3)=2×![]() =0.02mol,0.02mol Fe2+、0.01molH+共带有正电荷为0.05mol,0.02molI-带有负电荷为0.02mol,根据电荷守恒,原溶液中一定含有Cl-,其物质的量至少为0.04mol-0.02mol+0.01mol=0.03mol,故氯离子的浓度最小c(Cl-)=0.03mol÷0.1L=0.3mol/L。
=0.02mol,0.02mol Fe2+、0.01molH+共带有正电荷为0.05mol,0.02molI-带有负电荷为0.02mol,根据电荷守恒,原溶液中一定含有Cl-,其物质的量至少为0.04mol-0.02mol+0.01mol=0.03mol,故氯离子的浓度最小c(Cl-)=0.03mol÷0.1L=0.3mol/L。
A.根据分析可知,原溶液中一定含有Fe2+、I-、Cl-,A错误;
B.原溶液中一定不存在CO32-,一定含有Cl-,B错误;
C.原溶液中一定存在Fe2+,一定不存在Fe3+,C错误;
D.根据分析可知该溶液中c(Cl-)≥0.3mol/L,D正确;
故合理选项是D。

 阅读快车系列答案
阅读快车系列答案