题目内容
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
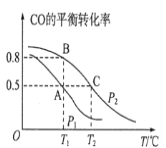
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是______。
③下列叙述能说明上述反应能达到化学平衡状态的是__(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变 c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=___,再加入1.0molCO后重新到达平衡,则CO的转化率__(填“增大,不变或减小”)。
【答案】PA<PB KA=KB>KC b 100 减小
【解析】
(1)①反应CO(g)+2H2(g)CH3OH(g)的正反应方向是气体物质的量减小的反应,加压平衡正向移动,反应物转化率增大;
②化学平衡常数只受温度的变化而变化,温度相同平衡常数相同,平衡转化率减小时,平衡常数减小;
③达到化学平衡时,正、逆反应速率相等,但用不同的物质的反应速率表示平衡状态时,必须满足“一正一逆,且等于系数之比”;各个组分的浓度、百分含量保持不变;根据化学平衡的特征,由此衍生出的一系列物理量都不变,但必须是变化的量不变了,才可以判断平衡状态,据此分析;
(2)P1压强、T1°C时,CO的转化率为0.5,根据CO的转化量,进而计算平衡时各物质的浓度,得到平衡常数;其它条件不变,增加一种反应物的浓度,可以提高另一反应物的转化率,而本身转化率是降低的。
(1)①反应CO(g)+2H2(g)CH3OH(g)的正反应方向是气体物质的量减小的反应,加压平衡正向移动,反应物转化率增大,则PA< PB;
②化学平衡常数只受温度的变化而变化,A、B两点的温度相同,所以KA=KB,由B→C点,CO的平衡转化率减小,可得KB>KC,所以KA=KB>KC;
③a.H2的消耗速率和CH3OH生成速率都表示正反应速率,不能判断平衡状态,a项错误;
b.CH3OH的体积分数不再改变,能判断平衡状态,b项正确;
c.因为容器容积不变,根据质量守恒定律知混合气体的总质量不变,因此混合气体的密度始终不变,因此混合气体的密度不再改变,不能判断平衡状态,c 项错误;
d.因为随着反应的进行,在平衡之前,CO物质的量不断减少,CH3OH的物质的量不断增多,且CO减少的量等于CH3OH增多的量,因此CO和CH3OH的物质的量之和始终保持不变,所以不能判断平衡状态,d 项错误;
答案选b;
(2)根据已知信息,在一容积为2 L的密闭容器内,充入0.2 mol CO与0.4 mol H2发生反应,在压强为P1、温度为T1℃时,到达平衡时CO转化率为0.5,则CO的减少量为0.2mol×0.5=0.1mol,可列出三段式计算该温度下的平衡常数,
CO(g)+2H2(g)CH3OH(g)
反应前(mol/L) 0.1 0.2 0
转化(mol/L) 0.05 0.1 0.05
平衡时(mol/L) 0.05 0.1 0.05
化学平衡常数, ![]() ;
;
再加入1.0 mol CO,平衡向正反应方向移动,重新达到平衡,氢气的转化率增大,CO的转化率减小。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D