题目内容
【题目】高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:
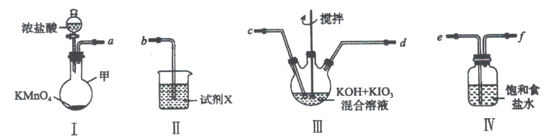
(1)装置I中仪器甲的名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X是___________。
(4)装置Ⅲ中搅拌的目的是___________。
(5)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O
KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O
I2+2Na2S2O3===2NaI+N2S4O6
则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
【答案】圆底烧瓶 16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑ NaOH溶液 使反应混合物混合均匀,反应更充分 aefcdb 2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O 降低KIO4的溶解度,减少晶体损失
KIO4+2KCl+ H2O 降低KIO4的溶解度,减少晶体损失 ![]() 100%
100%
【解析】
本题为制备高碘酸钾实验题,根据所提供的装置,装置III为KIO4的制备反应发生装置,发生的反应为2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O;装置I可用来制取氯气,为制备KIO4提供反应物氯气;装置IV是氯气的净化装置;装置II是氯气的尾气吸收装置;装置的连接顺序为I→IV→III→II,以此分析解答。
KIO4+2KCl+ H2O;装置I可用来制取氯气,为制备KIO4提供反应物氯气;装置IV是氯气的净化装置;装置II是氯气的尾气吸收装置;装置的连接顺序为I→IV→III→II,以此分析解答。
(1)根据装置I中仪器甲的构造,该仪器的名称是圆底烧瓶,
因此,本题正确答案是:圆底烧瓶;
(2)浓盐酸与KMnO4反应生成氯化钾、氯化锰、氯气和水,根据得失电子守恒及电荷守恒和原子守恒写出离子方程式是2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,
因此,本题正确答案是:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3) 装置II是氯气的尾气吸收装置,所用的试剂X应是NaOH溶液,
因此,本题正确答案是:NaOH溶液;
(4) 装置III为KIO4的制备反应发生装置,用氯气和NaOH的KIO3溶液反应,搅拌的目的是使反应混合物混合均匀,反应更充分,
因此,本题正确答案是:使反应混合物混合均匀,反应更充分;
(5)根据以上分析,装置的连接顺序为I→IV→III→II,所以各接口顺序为aefcdb,
因此,本题正确答案是:aefcdb;
(6)①装置III为KIO4的制备反应发生装置,氯气将KIO3氧化为KIO4,本身被还原为KCl,化学方程式为2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O,
KIO4+2KCl+ H2O,
因此,本题正确答案是:2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O;
KIO4+2KCl+ H2O;
②根据题给信息,高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,所以,与选用热水相比,选用冷水洗涤晶体的优点是降低KIO4的溶解度,减少晶体损失,
因此,本题正确答案是:降低KIO4的溶解度,减少晶体损失;
③设ag产品中含有KIO3和KIO4的物质的量分别为x、y,则根据反应关系:
KIO3~~~3I2,KIO4~~~4I2,I2~~~2Na2S2O3,
①214x+230y=a,②3x+4y=0.5b,联立①、②,解得y=![]() mol,
mol,
则该产品中KIO4的百分含量是![]() 100%=
100%=![]() 100%,
100%,
因此,本题正确答案是:![]() 100%。
100%。

 阅读快车系列答案
阅读快车系列答案