题目内容
【题目】下列卤代烃在KOH醇溶液中加热不反应的是
![]() ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ②③⑤ B. ①③⑥ C. ②④⑤ D. 全部
【答案】C
【解析】
卤代烃的消去反应是在碱的醇溶液中加热,连接-X的碳的相邻碳原子上的一个H和-X一同被脱去,而生成不饱和烃和卤化氢。
①氯苯中相邻的碳原子是苯环的一部分,可以在碱性条件下发生水解反应,①错误;
②和溴相连的碳的相邻碳原子上有氢,故能消去,生成对应的烯烃和溴化钾,②正确;
③和氯相连的碳相邻碳原子上没有氢,不能发生消去反应,③错误;
④和氯或溴相连的碳相邻碳原子上有氢,故能消去,生成对应的烯烃或炔烃和氯化钾,故④正确;
⑤和溴相连的碳上有氢,故能发生消去反应,生成对应的烯烃和氯化钾,故⑤正确;
⑥卤代烃中连在卤原子的碳原子必须有相邻的碳原子且此相邻的碳原子上,并且还必须连有氢原子时,才可发生消去反应,而该题中一氯甲烷只有一个碳,没有相邻的碳,⑥错误;
答案为C

 阅读快车系列答案
阅读快车系列答案【题目】游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,则活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
Ⅰ. 氮的活化
工业合成氨是氮的活化重要途径之一,在一定条件下,将N2 和 H2 通入到体积为0.5L的恒容容器中,反应过程中各物质的物质的量变化如图所示:

(1)10min内用NH3表示该反应的平均速率,v(NH3)=____________。
(2)在第10min和第25min改变的条件可能分别是_________、________(填字母)。
A.加了催化剂 B. 升高温度 C. 增加NH3的物质的量
D.压缩体积 E.分离出氨气
(3)下列说法能说明该可逆反应达到平衡状态的是__________(填字母)。
A. 容器中气体密度不变 B. 容器中压强不变
C. 3v(H2)正=2v(NH3)逆 D. N2、H2、NH3分子数之比为1∶3∶2
Ⅱ.催化转化为惰性氮 已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(4)在250C、101KPa时,N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol.
2NH3(g) △H1= -92.4kJ/mol.
2H2(g)+O2(g)=2H2O(l) △H2= -571.6 kJ/mol
N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式______________________________。
(5)在有氧条件下,新型催化剂M能催化CO与NOx反应生成N2。现向某密闭容器中充入等物质的量浓度的NO2和CO气体,维持恒温恒容,在催化剂作用下发生反应:
4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H<0,相关数据如下:
N2(g)+4CO2(g) △H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①计算此温度下的化学平衡常数K=______,
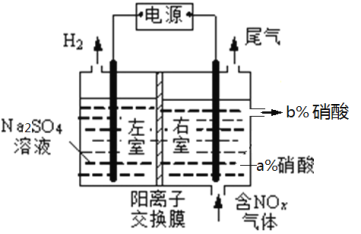
②实验室模拟电解法吸收NOx装置如图,(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验(a<b),电解时NO2发生反应的电极反应式:_________________________________。