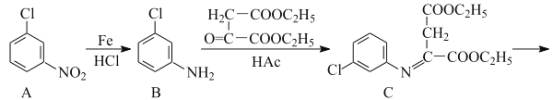
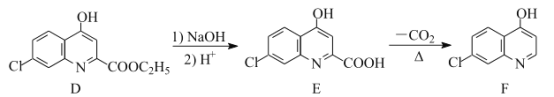
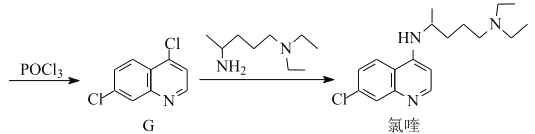
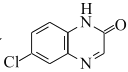
题目内容
【题目】前四周期元素 A、B、C、D、E 的原子序数依次增大,A 元素原子的核外电子只有一种运动状 态;基态 B 原子 s 能级的电子总数比 p 能级的多 1;基态 C 原子和基态 E 原子中成对电子数均是未成对电 子数的 3 倍;D 形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1) E 的元素名称为________。
(2)元素 A、B、C 中,电负性最大的是________(填元素符号,下同),元素 B、C、D 第一电离能由大到小的顺序为________。
(3)与同族其它元素 X 形成的 XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28'(填“>”“<”或“=”),请写出与BA3互为等电子体的一个离子________。
(4)BC3 离子中 B 原子轨道的杂化类型为________,BC3 离子的立体构型为________。
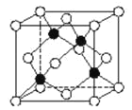
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图 所示)相似。若 DB 的晶胞参数为 a pm,则晶体的密度为________g·cm3(用NA表示阿伏加德罗常数)。
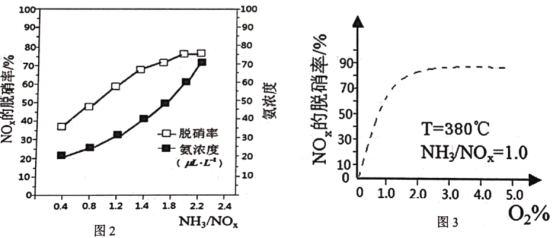
【答案】铬 O N>O>Al NH3分子间易形成氢键 < H3O+ sp2 平面三角形 ![]() ×1030。
×1030。
【解析】
前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态,则A为H元素;基态C原子中成对电子数是未成对电子数的3倍,为O元素;基态B原子s能级的电子总数比p能级的多1,则B为N元素;D形成简单离子的半径在同周期元素形成的简单离子中最小,原子序数大于C,为Al元素;基态E原子中成对电子数是未成对电子数的3倍,且原子序数大于D,则E为Cr元素,通过以上分析知,A、B、C、D、E分别是H、N、O、Al、Cr元素。
(1) E为Cr,E 的元素名称为铬,故答案为:铬;
(2)元素的非金属性越强,其电负性越大,非金属性O>N>H,则电负性O>N>H,所以电负性最大的是O元素;同一主族元素第一电离能随着原子序数增大而减小,则第一电离能B>Al,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,则第一电离能N>O,所以第一电离能N>O>Al,故答案为:O;N>O>Al;
(3)氨气分子之间存在氢键导致其易液化;氨气分子中N原子含有一个孤电子对和3个共价键,甲烷分子C原子形成4个共价键,孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以氨气分子键角小于甲烷分子中键角,即分子中键角<109°28′;等电子体满足两个条件:①原子个数相同,②价电子数相同,与NH3互为等电子体的一个离子为H3O+,故答案为:氨气分子间易形成氢键;<;H3O+;
(4)B、C分别为N、O,形成NO3-离子中N原子价层电子对个数3,且没有孤电子对,根据价层电子对互斥理论判断N原子杂化类型为sp2,该微粒空间构型平面三角形,故答案为:sp2;平面三角形;
(5)该晶胞中Al原子个数为4、N原子个数为4,该晶胞体积为(a×10-10cm)3,该晶体密度为![]() ,故答案为:
,故答案为:![]() 。
。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】扁桃酸是唯一具有脂溶性的果酸,在医药工业可用于头孢羟唑、血管扩张药环扁桃酸酯、滴眼药羟苄唑、匹莫林等的中间体,也可作防腐剂。实验室用如下原理制备:

合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:

步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。
步骤二:将反应液用200mL水稀释,每次用20mL乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。请回答下列问题:
(1)图中仪器C的名称是_________________,装置B的作用是_____________
(2)步骤一中合适的加热方式是_____________________。
(3)步骤二中用乙醚的目的是_____________________。
(4)步骤三中加入适量无水硫酸钠的目的是_____________________。
(5)该实验的产率为____________(保留三位有效数字)。
(6)扁桃酸在高端化学中也有很重要的作用,如以扁桃酸与正丁醇为原料,在催化剂的催化下可合成手性拆分剂扁桃酸正丁酯,试写出该反应的化学方程式___________。
【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法不正确的是( )
A.实验①中,若5min未测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速v(N)=1.0×10-3mol·L-1·min-1
B.实验②中,达到平衡时,Y的转化率为20%
C.实验③中,该反应的平衡常数K=1.0
D.实验④中,达到平衡时, b>0.060
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)用蒸馏水稀释0.10mol/L的醋酸,则下列各式表示的数值随水量的增加而增大的是_____;
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)。