题目内容
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(1)在这些元素中,化学性质最不活泼的是: 。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是: 。
(3)比较①与⑤的最高价氧化物对应的水化物, 的酸性强(填化学式);能通过 说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式 。
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为 。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因 (用化学方程式表示)。
(6)比较③与⑥的氢化物, 更稳定(填化学式)。
(7)写出④的单质与水反应的离子方程式 。
(8)写出⑦元素的离子结构示意图 ,该离子半径 S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置 。
(1)Ar;
(2)HClO4 KOH;
(3)H2CO3 Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
(4)2NH3Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O NH4NO3;
CaCl2+2NH3↑+2H2O NH4NO3;
(5)3NO2+H2O=2HNO3+NO
(6)H2O
(7)2Na+2H2O=2Na++2OH-+H2↑
(8)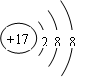 ,<,第四周期ⅦA族
,<,第四周期ⅦA族
解析试题分析:这几种元素分别是:①C;②N ;③O;④Na;⑤Si;⑥S ;⑦Cl ; ⑧Ar; ⑨K; ⑩Br。同一周期的元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强,最后以最不活泼的惰性气体元素结束。在同一主族的元素,从上到下,元素的原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱。(1)在这些元素中,化学性质最不活泼的是⑧Ar元素; (2)在最高价氧化物的水化物中,酸性最强的化合物的HClO4。碱性最强的化合物KOH。(3)C、Si是同一主族的元素,非金属性C>Si。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。因此比较①与⑤的最高价氧化物对应的水化物的酸性强的是H2CO3。可以通过反应CO2+H2O + Na2SiO3= H2SiO3↓+ Na2CO3证明。(4)在实验室一般是用铵盐与碱共热来制取氨气的。制取NH3的方程式为2NH3Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。②的氢化物NH3与②的最高价氧化物的水化物HNO3反应:NH3+ HNO3= NH4NO3.因此反应产物是NH4NO3。(5)NO2是红棕色气体,它能溶解于水,发生反应3NO2+H2O=2HNO3+NO。(6)③O与⑥S是同一主族的元素,由于非金属性O>S。元素的非金属性越强,其对应的氢化物的稳定性就越强。元素稳定性H2O >H2S。(7)Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑。(8)Cl-离子结构示意图为:
CaCl2+2NH3↑+2H2O。②的氢化物NH3与②的最高价氧化物的水化物HNO3反应:NH3+ HNO3= NH4NO3.因此反应产物是NH4NO3。(5)NO2是红棕色气体,它能溶解于水,发生反应3NO2+H2O=2HNO3+NO。(6)③O与⑥S是同一主族的元素,由于非金属性O>S。元素的非金属性越强,其对应的氢化物的稳定性就越强。元素稳定性H2O >H2S。(7)Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑。(8)Cl-离子结构示意图为: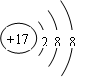 .Cl-、S2-核外电子排布都是2、8、8.电子层结构相同。对于电子层结构相同的微粒来说,离子的核电荷数也多,离子半径就越小。因此离子半径Cl-<S2-。⑩元素Br在周期表的位置是位于第四周期第ⅦA族。
.Cl-、S2-核外电子排布都是2、8、8.电子层结构相同。对于电子层结构相同的微粒来说,离子的核电荷数也多,离子半径就越小。因此离子半径Cl-<S2-。⑩元素Br在周期表的位置是位于第四周期第ⅦA族。
考点:考查元素的推断、元素的原子或离子半径的比较、元素形成的氢化物、酸是酸性强弱的比较、气体实验室制法、离子方程式的书写的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(16分)X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子最外层电子排布式为nsnnpn |
| Y | Y是空气中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的单质是常见的半导体材料 |
(2)Z的单质与W的单质相比熔点较高的是 (写化学式);Z与W原子半径较大的是 (写化学式)
(3)X的一种氧化物XO2分子中σ键与∏键数目之比为
(4)X的第一电离能比W的 (填“大”或“小”)
(5)写出X的单质与Y的最高价氧化物水化物的浓溶液在加热的条件下反应的化学方程式:
(6)已知2.7gZ单质与足量Y单质反应,放出31.8kJ的热量,请写出此反应的热化学方程式: 。
 、
、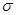 ”或“
”或“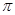 ”)。
”)。

 、
、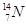 、
、 、
、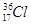 、
、 、
、 中;
中;