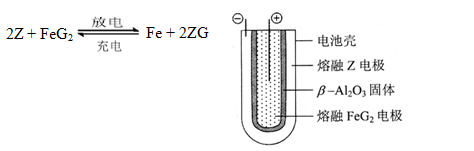
题目内容
A、B、C、D代表元素周期表中4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,该元素氢化物比同族元素氢化物熔沸点高的原因是 ;第一电离能比后面一号元素大的原因是
(2)B元素与氧元素形成的一种化合物是含有4个原子18个电子的分子,该化合物的电子式为 ,若向该化合物的稀溶液中加入少量二氧化锰,有无色气体产生,该反应的化学方程式为
(3)C元素的正三价离子的 3d轨道为半充满状态,C元素的符号为 ,在同期表中位于 周期 族,原子结构示意图为
(4)D元素位于元素周期表第四周期第ⅠB族,其基态原子的电子排布式为
⑴NH3分子间有氢键;第一电离能不O大的原因是 N原子的2P轨道是半充满的较稳定状态;
⑵ 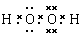 ; 2H2O2
; 2H2O2 2H2O+O2↑
2H2O+O2↑
⑶Fe,位于第四周期Ⅷ族,原子结构示意图 ⑷1s22s22p63s23p63d104s1或[Ar] 3d104s1
⑷1s22s22p63s23p63d104s1或[Ar] 3d104s1
解析试题分析:根据题意可知:A是N;其相应的氢化物NH3的熔沸点比同族元素氢化物熔沸点高是因为在NH3分子间除了存在一般的分子间作用力外,还存在有氢键,增加了分子之间的相互作用。一般情况下,同一周期的元素,元素的原子序数越大,元素的非金属性越强,原子半径越小,失去电子越难,第一电离能越大,但是由于N原子2P轨道处于半充满的稳定状态,所以比O元素的第一电离能大。(2)B元素是H,它与O形成的18个电子的分子是H2O2,电子式为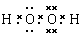 ;H2O2在MnO2催化作用下反应的化学方程式为2H2O2
;H2O2在MnO2催化作用下反应的化学方程式为2H2O2 2H2O+O2↑;(3)C元素的正三价离子核外电子排布为1s22s22p63s23p63d5,则C是26号元素Fe,该元素在周期表中位于第四周期Ⅷ族,原子结构示意图为
2H2O+O2↑;(3)C元素的正三价离子核外电子排布为1s22s22p63s23p63d5,则C是26号元素Fe,该元素在周期表中位于第四周期Ⅷ族,原子结构示意图为 ;(4)D元素是29号元素Cu,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar] 3d104s1
;(4)D元素是29号元素Cu,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar] 3d104s1
考点:考查元素的推断、电离能的比较、化学用语的应用、物质熔沸点高低的原因的知识。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
(12分) 类推法是科学学习的重要方法之一
⑴下列类推结论正确的是
| | 类比对象 | 结论 |
| A | Cl2+H2O HCl+HClO HCl+HClO | I2+H2O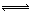 HI+HIO HI+HIO |
| B | C+2CuO ="==" 2Cu+CO2↑(条件:加热) | C+SiO2 ="==" Si+ CO2↑(条件:加热) |
| C | Na2O+H2O ="=" 2NaOH | CuO+H2O ="=" Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
② 碲的化合价可能的范围_______ ;
③ 硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式);
④ 氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为___________________________________。
(24分)下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | | | | ⑧ | |
| 4 | ⑨ | ⑩ | | | | | | |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素在第 族;写出它的氧化物与氢氧化钠溶液反应的离子方程式 。
(4)从⑤到⑧的元素中, 原子半径最大(填元素符号)。
(5)元素④与⑥形成的化合物属于 (填 “共价”或“离子”)化合物。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A、将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B、比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C、将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D、将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(1)在这些元素中,化学性质最不活泼的是: 。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是: 。
(3)比较①与⑤的最高价氧化物对应的水化物, 的酸性强(填化学式);能通过 说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式 。
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为 。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因 (用化学方程式表示)。
(6)比较③与⑥的氢化物, 更稳定(填化学式)。
(7)写出④的单质与水反应的离子方程式 。
(8)写出⑦元素的离子结构示意图 ,该离子半径 S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置 。
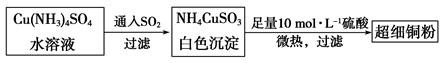
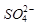 的空间构型为_____________,
的空间构型为_____________,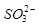 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。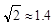 ,列式并计算结果)。
,列式并计算结果)。