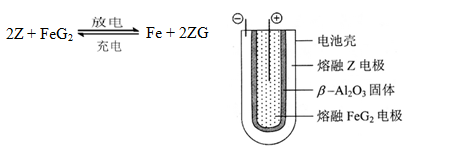
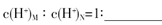题目内容
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。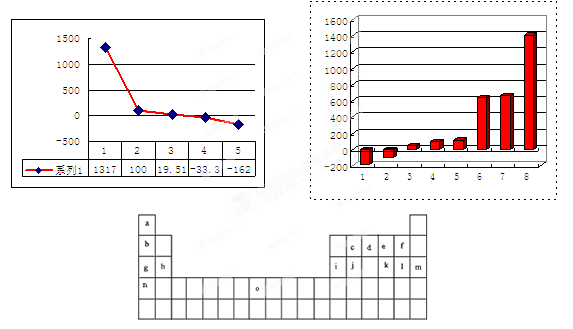
试回答下列问题
(1)元素“O”在周期表中的位置是 。
(2)画出“c”的简化电子排布式 。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为: ;序列“1”氢化物的电子式为: 。
(1)第四周期第Ⅷ族; (2)[He]2s22p2(3)m(4)CH4; 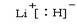
解析试题分析:(1)根据给出的元素周期表可确定元素“O”在周期表中的位置是第四周期第Ⅷ族。(2)“c”在元素周期表中位于第二周期第ⅣA。该元素是C。的简化电子排布式是[He]2s22p2。(3)第三周期8种元素有Na、Mg、Al、Si、P、S、Cl、Ar。同一周期的元素,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强。元素的金属性越强,其金属单质的熔点就越低。元素的非金属性越强,其单质的熔沸点就越高。其中序列“1”的熔点最低,代表的是Ar。字母代号为m.(4)b、c、d、e、f分别是Li、C、N、O、F。在这些元素形成的氢化物中LiH是离子晶体,其余的都是分子晶体。离子晶体通过离子键结合,断裂较难,所以沸点最高,而在其余的氢化物中,由于HF、H2O、NH3的分子间存在分子间作用力和氢键,所以沸点高于同主族其它元素形成的氢化物的沸点。而CH4则符合一般的规律。即相对分子质量越大,分子间作用力就越大,物质的沸点就越高。由于CH4式量最小,分子间以分子间作用力结合,所以沸点最低。序列“5”氢化物的化学式为:CH4;序列“1”氢化物的LiH,其电子式为: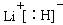 。
。
考点:考查元素周期表及元素周期律的应用的知识。

(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。

(24分)下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | | | | ⑧ | |
| 4 | ⑨ | ⑩ | | | | | | |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素在第 族;写出它的氧化物与氢氧化钠溶液反应的离子方程式 。
(4)从⑤到⑧的元素中, 原子半径最大(填元素符号)。
(5)元素④与⑥形成的化合物属于 (填 “共价”或“离子”)化合物。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A、将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B、比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C、将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D、将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(1)在这些元素中,化学性质最不活泼的是: 。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是: 。
(3)比较①与⑤的最高价氧化物对应的水化物, 的酸性强(填化学式);能通过 说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式 。
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为 。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因 (用化学方程式表示)。
(6)比较③与⑥的氢化物, 更稳定(填化学式)。
(7)写出④的单质与水反应的离子方程式 。
(8)写出⑦元素的离子结构示意图 ,该离子半径 S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置 。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
(1)在这些元素中,化学性质最不活泼的是: (填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的电子式是: 。
(3)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为: 。
(5) ②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因 。
(6) 用结构式表示元素①与③形成的化合物 ,该化合物在固体时俗称 ,属于 晶体,指出它的一种用途 。
下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质
可在空气中燃烧。
| W | X | Y |
| | | Z |
请回答下列问题:
(1)Z的元素符号是 ,写出Z的原子结构示意图: 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为 。
(3)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
| 1 | | |
| 2 | | |
(4)由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式: 。