题目内容
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A.0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA
B.1 mol氯气分别与足量铁和铝完全反应时转移的电子数均为3NA
C.28 g乙烯与丙烯混合物中含有C-H键的数目为4NA
D.25℃时1L pH=1的H2SO4溶液中含有H+的数目为0.2NA
【答案】C
【解析】
A. NH4NO3溶液的浓度为0.1mol·L-1,溶液体积不确定,不能计算含有的氮原子数,A错误;
B.氯气分别与足量铁和铝完全反应时,化合价均由0价变-1价,1 mol氯气转移的电子数均为2NA,B错误;
C.如果28g全为乙烯,则含有的C-H键数目 = ![]() ×4×NA = 4NA ;如果28g全为丙烯,则含有的C-H键数目 =
×4×NA = 4NA ;如果28g全为丙烯,则含有的C-H键数目 =![]() ×6×NA = 4NA ,所以无论以何种比例混合,28 g乙烯与丙烯混合物中C-H键数目始终为 4NA ,C正确;
×6×NA = 4NA ,所以无论以何种比例混合,28 g乙烯与丙烯混合物中C-H键数目始终为 4NA ,C正确;
D. pH=1的H2SO4溶液中,H+的浓度为0.1 mol·L-1,故1L溶液中含有H+的数目为0.1NA,D错误;
故选C。

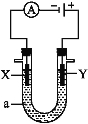
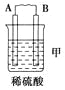
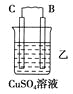
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知:当铁的浸出率为70%时,所采用的实验条件为____________________。

(2) “酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率 | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_____________________。
(4)Li2Ti5O15中Ti的化合价为![]() ,其中过氧键的数目为______________。
,其中过氧键的数目为______________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________。