题目内容
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题。
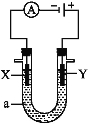
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
(1)电解池中X极上的电极反应式是 ,在X极附近观察到的现象是 。
(2)Y电极上的电极反应式是 ,检验该电极反应产物的方法是 。
【答案】(1)2H++2e-![]() H2↑ 放出气体,溶液变红
H2↑ 放出气体,溶液变红
(2)2Cl--2e-![]() Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝
Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝
【解析】由题意或图像可知,此池为电解池,X极为阴极,Y极为阳极。电极为惰性电极,饱和NaCl溶液中存在Na+、Cl-、H+、OH-,在阴极上,H+放电能力强于Na+,故阴极上发生的电极反应式为2H++2e-![]() H2↑,因而导致X极附近有气体放出,溶液呈碱性,溶液颜色由无色变为红色;在阳极上,Cl-放电能力强于OH-,故阳极上发生的电极反应式为2Cl--2e-
H2↑,因而导致X极附近有气体放出,溶液呈碱性,溶液颜色由无色变为红色;在阳极上,Cl-放电能力强于OH-,故阳极上发生的电极反应式为2Cl--2e-![]() Cl2↑。
Cl2↑。

【题目】乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值。
Ⅰ.乙醇可以作为燃料燃烧。
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量。应用表中数据(25℃、101 kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式_____________。
键 | C—C | C—H | O=O | H—O | C—O | C=O |
键能/(kJmol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
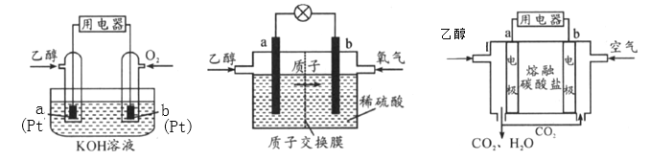
碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为_________。
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_________,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_________。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_________,通过质子交换膜的离子是_________。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_________(填“a”或“b”)移动,电极b上发生的电极反应式为_________。
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g) + C2H4(g) ![]() CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
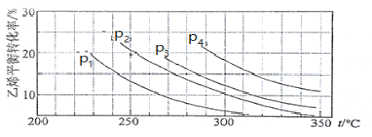
(1)图中压强P1、P2、P3、P4的大小顺序为:_________,理由是:_________。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。该条件下乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________、_________。
Ⅳ.探究乙醇与溴水是否反应。
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如下:
实验编号 | 实验步骤 | 实验现象 |
1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是_________。
②实验3的作用是_________。
③根据实验现象得出的结论是_________。
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应_________(已知若发生氧化反应,则Br2全部转化为HBr)。