题目内容
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:

试回答:
(1)操作I为 (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为 。
(3)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)。
③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为 。


试回答:
(1)操作I为 (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为 。
(3)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)。
③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为 。

(1)过滤(1分) (2)Fe+2Fe3+=3Fe2+(1分) Fe+2H+=Fe2++H2↑(1分)
(3)蒸发浓缩(1分)、洗涤(1分) (4)①1000mL容量瓶 (1分)②b(1分)
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
④滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟内不再褪色(2分)偏低(2分)
⑤ 96.7%(2分)
(3)蒸发浓缩(1分)、洗涤(1分) (4)①1000mL容量瓶 (1分)②b(1分)
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
④滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟内不再褪色(2分)偏低(2分)
⑤ 96.7%(2分)
试题分析:(1)由于烧渣中含有与稀硫酸以及氧气不反应的二氧化硅,所以操作I是过滤。
(2)由于滤液中含有铁离子以及过量的稀硫酸。而最终制备的是绿矾,所以需要将溶液中的铁离子还原为亚铁离子,因此试剂Y是铁粉,所以有关反应的离子方程式为Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑。
(3)操作Ⅲ的目的是得到绿矾晶体,所以正确的操作应该是蒸发浓缩、冷却结晶、过滤、洗涤然后干燥即可。
(4)①准确配制一定物质的量浓度溶液的主要仪器是容量瓶,所以步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需1000ml容量瓶。
②由于酸性高锰酸钾溶液具有强氧化性与酸性,因此应该放在酸式滴定管中,答案选b。
③酸性高锰酸钾溶液具有强氧化性,能把亚铁离子氧化生成铁离子,而自身被还原为Mn2+,因此该反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
④由于酸性高锰酸钾溶液显紫红色,所以判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟内不再褪色;由于滴定管的刻度自上而下逐渐增大,所以若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则读数值偏小。如果其它操作均正确,则使测定结果偏低。
⑤根据反应式可知,反应中消耗亚铁离子的物质的量=0.01000mol/L×0.02000L×5=0.001mol,则原样品中绿矾的物质的量=0.001mol×
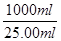 =0.04mol,质量=0.04mol×278g/mol=11.12g,所以上述样品中FeSO4·7H2O的质量分数为
=0.04mol,质量=0.04mol×278g/mol=11.12g,所以上述样品中FeSO4·7H2O的质量分数为 ×100%=96.7%。
×100%=96.7%。
练习册系列答案
相关题目




 溶液A
溶液A

 莫尔盐
莫尔盐

