题目内容
【题目】秋冬季是雾霾高发季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_______________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有_____________________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式 ___________________。
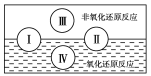
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。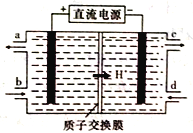
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
【答案】CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol AC 2.56×105 降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可) NO+NO2 +2OH- =2NO2- +H2O a 2NO2-+8H++6e-=N2↑+4H2O
N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol AC 2.56×105 降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可) NO+NO2 +2OH- =2NO2- +H2O a 2NO2-+8H++6e-=N2↑+4H2O
【解析】
(1)①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
利用盖斯定律将(①+②)![]() 2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此计算反应热;
2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此计算反应热;
(2)①根据平衡状态时,各物质浓度保持不变,正反应速率等于逆反应速率以及相关量不变来判断;
②利用三段式法计算平衡浓度,根据平衡常数表达式计算;
③为了提高尾气处理的效果,可从增大转化率和加快反应速率角度分析;
(3)从氧化还原反应的角度判断反应产物,进而写出相关反应的离子方程式;
(4)①Ce4+是氧化产物,在阳极生成,从电解槽的a口流出。
②阴极发生还原反应,在阴极NO2-转化为N2,以此写出阴极的电极反应式。
(1)将已知的两个热化学方程式相加再除以2可得甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=[(-574kJ/mol)+(-1160kJ/mol
)]=一867kJ/mol,
因此,本题正确答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=一867kJ/mol;
(2)①A.c(NO)随着反应进行而改变,当c(NO)不再改变时,说明反应达到平衡状态,故A可判断反应达到平衡状态;
B.c(NO)/c(CO)与平衡状态之间没有一定关系,故B不能判断反应达到平衡状态;C.c(NO/c(CO2)随着反应进行而改变,当c(NO/c(CO2)不再改变时,说明反应达到平衡状态,故C可判断反应达到平衡状态;
D.V(NO)和V(CO)都是正反应速率,不能说明正反应速率等于逆反应速率,故D不能判断反应达到平衡状态。
故选AC。
② 2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(×10-3mol/L)9.00 9.00 0 0
转化(×10-3mol/L) 8.00 8.00 4.00 8.00
平衡(×10-3mol/L) 1.00 1.00 4.00 8.00
由此可知,此条件下达到平衡时,c(NO)=1.00×10-3mol/L,c(CO)=1.00×10-3mol/L,c(CO2)=8.00×10-3mol/L,c(N2)=4.00×10-3mol/L,
该反应的平衡常数K=![]() =
=![]() =2.56×105,
=2.56×105,
③为了提高尾气处理的效果,可采取的措施有降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等。
因此,本题正确答案为:AC ;2.56×105;降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可);
(3)氢氧化钠溶液吸收NO和NO2(两者体积比1:1)则生成NO2-,离子方程式为NO+NO2 +2OH- =2NO2- +H2O,
因此,本题正确答案为:NO+NO2 +2OH- =2NO2- +H2O;
(4)①Ce4+是氧化产物,在阳极生成,从电解槽的a口流出;
②阴极发生还原反应,在阴极NO2-转化为N2,则阴极的电极反应式为:2NO2- +8H++6e-=N2↑+4H2O,
因此,本题正确答案为:a ;2NO2-

 阅读快车系列答案
阅读快车系列答案