��Ŀ����
����Ŀ���������ǹ����������ڵĻ������ʣ������ʵ����Ԫ����Ҫ���⡢̼������������ͬʱ������Ԫ������п�ȡ��ش��������⣺
(1)̼����������Ԫ�صĵ�һ��������С�����˳��Ϊ________________(��Ԫ�ط��ű�ʾ)��
(2)N3�������幹����___________�Σ���N3����Ϊ�ȵ������һ�ַ�����___________(�����ʽ)��
(3)�������İ�ˮ��εؼ��뵽ZnSO4��Һ�У������ɳ�����Ȼ������ܽ����������[Cu(NH3)4SO4����λ�������е������ӽṹʽΪ___________��SO42���е���ԭ���ӻ���ʽΪ___________���ü۲���ӶԻ������۽���SO42���ļ��Ǵ���SO32����ԭ����_________________________________��
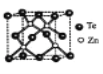
(4)�ڻ�п���������ֽṹ������һ�־����ṹ����ͼ����������Znԭ�Ӿ��������Teԭ��Χ��____��ͼ�Σ���Teԭ�Ӿ��������Teԭ����___������Zn����������Teԭ�Ӽ��Ϊapm�������ܶ�Ϊ____g/cm3��
(��֪���ԭ��������Zn-65��Te-128)
���𰸡�C<O<N ֱ�� N2O��CO2��BeCl2 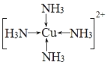 sp3 �������ӵ�������ԭ�Ӿ�Ϊsp3�ӻ��� SO42-��û�й¶Ե��ӣ�SO32-��һ�Թ¶Ե��ӣ��µ��ӶԶԳɼ������м�ѹ���ã���˼��Ǹ�С �������� 12
sp3 �������ӵ�������ԭ�Ӿ�Ϊsp3�ӻ��� SO42-��û�й¶Ե��ӣ�SO32-��һ�Թ¶Ե��ӣ��µ��ӶԶԳɼ������м�ѹ���ã���˼��Ǹ�С �������� 12 ![]()
��������
(1)����Ԫ�صĵ�һ�����ܱ仯���ɷ�����
(2)ԭ�Ӹ�������Ҽ۵�������ȵ���Ϊ�ȵ����壬N3-��CO2��Ϊ�ȵ����壬���߽ṹ���ƣ�
(3)���������������Cu�백����֮���γ���λ�����������SO42-��Sԭ�Ӳ���sp3�ӻ���������ԭ���Ƿ��йµ��ӶԷ���SO42����SO32-��
(4)�����ڻ�п����ṹ�����þ�̯������������Ŀ�������㾧���ܶȡ�
(1)һ�������ͬһ���ڵ�Ԫ�أ�Ԫ�ص�ԭ������Խ��Ԫ�صĵ�һ������Խ������Nԭ���������Ӵ���2p����İ�����ȶ�״̬������ʧȥ���ӱ�O�ѣ�����һ������N>O�����̼����������Ԫ�صĵ�һ��������С�����˳��ΪC<O<N��
(2)ԭ�Ӹ�������Ҽ۵�������ȵ���Ϊ�ȵ����壬����N3-��Ϊ�ȵ�����ķ����У�N2O��CO2��CS2�ȣ�N3-��CO2��Ϊ�ȵ����壬���߽ṹ���ƣ�����N3�������幹����Ϊֱ���ͽṹ��
(3)�������[Cu(NH3)4]SO4�еăȽ����ӵ�����Cu2+���ӣ���NH3��Nԭ���γ���λ�������4�������ӣ���λ�������е�������[Cu(NH3)4]2+Ϊ���������Σ� SO42-Ϊ������ӣ�����Sԭ�Ӳ���sp3�ӻ���������SO42������SO32-��Sԭ�Ӷ��Dz���sp3�ӻ�������SO42-��û�й¶Ե��ӣ�SO32-������Sԭ�����й¶Ե��ӣ��¶Ե��ӶԳɼ����Ӷ����ų����ã�ʹ����DZ�С��
(4)�����ڻ�п����ṹ��Te��Zn���λ�ÿ�֪����������Znԭ�Ӿ��������Teԭ�����ĸ�������Χ�����������Σ�Teԭ��λ�ھ����Ķ���������ϣ���һ����������Teԭ��λ���������ȵ�Teԭ��������ƽ������ģ�ͨ��һ�������ܹ��γ�8������������ÿ��Teԭ���ظ�����2�Σ�������Teԭ�Ӿ��������Teԭ���к���Teԭ�Ӹ�����(3��8)��2=12��������Zn���������Teԭ�Ӽ��Ϊapm������Znԭ��λ��������ĶԽ��ߵ�![]() �������Խ���Ϊ4apm�������ı߳�LΪ
�������Խ���Ϊ4apm�������ı߳�LΪ![]() pm����һ�������к���Te��
pm����һ�������к���Te��![]() ��6=4������Znԭ��Ϊ4������һ�������к���4��ZnTe���ʾ����ܶ�Ϊ
��6=4������Znԭ��Ϊ4������һ�������к���4��ZnTe���ʾ����ܶ�Ϊ![]() g/cm3��
g/cm3��

����Ŀ���ﶬ���������߷����ڣ���������β����ȼúβ���������������Ҫԭ��֮һ��
(1)��ҵ�����ü������ԭNOX�ɼ��ٵ���������ŷš���֪��
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)��H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)��H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)��H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)��H=-1160kJ/mol
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_______________________________��
(2)����β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H<O����һ�������µĺ����ܱ������г���NO��CO���ô�������ø÷�Ӧ�ڲ�ͬʱ��NO��CO��Ũ�����±���ʾ��
N2(g)+2CO2(g)��H<O����һ�������µĺ����ܱ������г���NO��CO���ô�������ø÷�Ӧ�ڲ�ͬʱ��NO��CO��Ũ�����±���ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol��L-1 | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
c(CO)/mol��L-1 | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
�����п��жϷ�Ӧ�ﵽƽ��״̬����___________(����ĸ����)��
A.c(NO)���ٸı� B.c(NO)/c(CO)���ٸı�
C.c(NO)/c(CO2)���ٸı� D.V(CO)=V(CO2)
�ڴ������´ﵽƽ��ʱ������÷�Ӧ��ƽ�ⳣ��K=________��
��Ϊ�����β��������Ч��,�ɲ�ȡ�Ĵ�ʩ��_____________________(д�����ּ���)��
(3)��ҵ�ϳ����á�����Һ���ա��ķ�����ͬʱ����SO2�͵�������������(NOx),��д������������Һ����NO��NO2�����������1��1�������ӷ���ʽ ___________________��
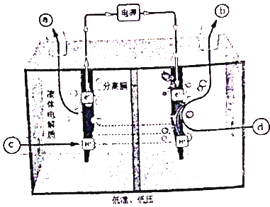
(4)��Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ��,������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ����,����NO2����NO3�����������ʵ���֮��Ϊ1:1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ������,ͬʱ����Ce4+,��ԭ������ͼ��ʾ��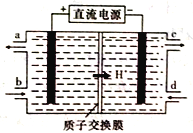
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��______________��