题目内容
【题目】下列反应中,氯元素全部被氧化的是( )
A. 2P+3Cl2![]() 2PCl3
2PCl3
B. 2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. NaOH+HClNaCl+H2O
D. 2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
【答案】B
【解析】
反应中氯元素全部被氧化,说明氯元素全部失电子化合价升高,发生氧化反应,据此分析解答。
A.该反应中Cl元素化合价由0价变为-1价,所以氯元素得电子化合价降低,全部被还原,A错误;
B.该反应中Cl元素化合价由-1价变为0价,所以Cl元素失电子化合价升高,全部被氧化,B正确;
C.该反应中没有电子转移,所以不是氧化还原反应,属于复分解反应,C错误;
D.该反应中Cl元素化合价由0价变为-1价、+1价,所以Cl元素被氧化、被还原,D错误;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】秋冬季是雾霾高发季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_______________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有_____________________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式 ___________________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。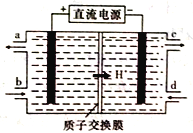
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
【题目】制备纯净的液态无水四氯化锡的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
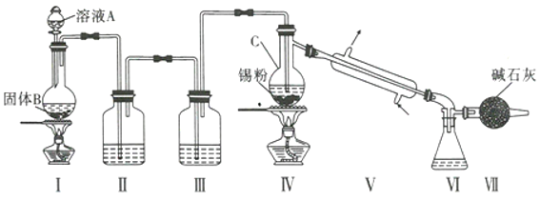
回答下列问题:
(1) Sn在元素周期表中的位罝为____________________________。
(2) Ⅱ、Ⅲ中的试剂分別为_______、__________;Ⅶ的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是_________________。
(6)写出SnCl4水解的化学方程式:________________________________________。



