��Ŀ����
����Ŀ����CH4����ԭNOX�������������������Ⱦ�����磺
��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=��1 160 kJmol��1��
��֪NO��NO2���������ܶ�����ͬ�����������ܶȵ�17����16 g����û������ȫ��Ӧ����N2��CO2��H2O��g���ų�1 042.8 kJ������������H1�ǣ�������
A. ��867 kJmol��1 B. ��574 kJmol��1 C. ��691.2 kJmol��1 D. ��925.6 kJmol��1
���𰸡�B
��������
NO��NO2���������ܶ�����ͬ�����������ܶȵ�17�������������ƽ����Է�������=17��2=34����NO�����ʵ�������Ϊx����NO2�����ʵ�������Ϊ1-x��30x+46(1-x)=34�����x=0.75������������NO��NO2�����ʵ���֮��Ϊ��0.75��0.25=3��1��16g��������ʵ���Ϊn=![]() =1mol����CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1����CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H2=��1 160 kJmol��1�����ݸ�˹����֪����+�ڵã�CH4(g)+2NO2(g)�TN2(g)+CO2(g)+2H2O(g) ��H=
=1mol����CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1����CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H2=��1 160 kJmol��1�����ݸ�˹����֪����+�ڵã�CH4(g)+2NO2(g)�TN2(g)+CO2(g)+2H2O(g) ��H=![]() �� (��H1-1 160 kJmol��1)��NO��NO2�����ʵ���֮��Ϊ3��1�����ݷ���ʽ֪����NO��NO2��ȫת��Ϊ����ʱ���ֱ��NO��NO2��Ӧ�ļ�������ʵ���֮��=
�� (��H1-1 160 kJmol��1)��NO��NO2�����ʵ���֮��Ϊ3��1�����ݷ���ʽ֪����NO��NO2��ȫת��Ϊ����ʱ���ֱ��NO��NO2��Ӧ�ļ�������ʵ���֮��=![]() ��
��![]() =3��2������0.6mol�����NO��Ӧ��0.4mol�ļ����NO2��Ӧ��16g����û������ȫ��Ӧ����N2��CO2��H2O(g)�ų�1042.8kJ����������0.6mol��1160kJ/mol+0.5(-��H1+1 160 kJmol��1)��0.4mol=1042.8kJ�������H1=-574kJ/mol����ѡB��
=3��2������0.6mol�����NO��Ӧ��0.4mol�ļ����NO2��Ӧ��16g����û������ȫ��Ӧ����N2��CO2��H2O(g)�ų�1042.8kJ����������0.6mol��1160kJ/mol+0.5(-��H1+1 160 kJmol��1)��0.4mol=1042.8kJ�������H1=-574kJ/mol����ѡB��

����Ŀ���ﶬ���������߷����ڣ���������β����ȼúβ���������������Ҫԭ��֮һ��
(1)��ҵ�����ü������ԭNOX�ɼ��ٵ���������ŷš���֪��
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)��H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)��H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)��H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)��H=-1160kJ/mol
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_______________________________��
(2)����β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H<O����һ�������µĺ����ܱ������г���NO��CO���ô�������ø÷�Ӧ�ڲ�ͬʱ��NO��CO��Ũ�����±���ʾ��
N2(g)+2CO2(g)��H<O����һ�������µĺ����ܱ������г���NO��CO���ô�������ø÷�Ӧ�ڲ�ͬʱ��NO��CO��Ũ�����±���ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol��L-1 | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
c(CO)/mol��L-1 | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
�����п��жϷ�Ӧ�ﵽƽ��״̬����___________(����ĸ����)��
A.c(NO)���ٸı� B.c(NO)/c(CO)���ٸı�
C.c(NO)/c(CO2)���ٸı� D.V(CO)=V(CO2)
�ڴ������´ﵽƽ��ʱ������÷�Ӧ��ƽ�ⳣ��K=________��
��Ϊ�����β��������Ч��,�ɲ�ȡ�Ĵ�ʩ��_____________________(д�����ּ���)��
(3)��ҵ�ϳ����á�����Һ���ա��ķ�����ͬʱ����SO2�͵�������������(NOx),��д������������Һ����NO��NO2�����������1��1�������ӷ���ʽ ___________________��
(4)��Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ��,������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ����,����NO2����NO3�����������ʵ���֮��Ϊ1:1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ������,ͬʱ����Ce4+,��ԭ������ͼ��ʾ��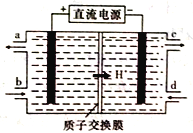
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��______________��