题目内容
13.NA为阿伏加德罗常数,下列有关说法中正确的是( )| A. | 2.3 g Na被O2完全氧化生成Na2O和Na2O2混合物时,失去电子数为0.1~0.2 NA | |
| B. | 常温下,64 g SO2所含的氧原子数为2NA | |
| C. | 标准状况下,等物质的量的SO2和SO3所占体积相同 | |
| D. | 100 mL 0.1 mol•L-1的硫酸铝溶液中含有的Al3+为0.02NA个 |
分析 A.钠与氧气反应,无论生成氧化钠还是过氧化钠,钠都是由0→+1价;
B.质量转换为物质的量,结合1个二氧化硫分子中含有2个氧原子解答;
C.等物质的量的物体之中,气体的体积远大于固体和液体;
D.铝离子为弱碱阳离子,水溶液中部分发生水解.
解答 解:A.2.3g钠的物质的量为0.1mol,0.1mol钠完全反应失去0.1mol电子,失去的电子数一定为0.1NA,故A错误;
B.64 g SO2的物质的量为$\frac{64g}{64g/mol}$=1mol,含的氧原子数为2NA,故B正确;
C.标况下,二氧化硫为气体,三氧化硫为液体,所以等物质的量的SO2和SO3所占的体积不相同,故C错误;
D.100 mL 0.1 mol•L-1的硫酸铝溶液中含有硫酸铝的物质的量为0.01mol,但是铝离子部分水解所以,含的Al3+小于0.02NA个,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的计算及应用,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积适用对象,注意盐类的水解,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
3.两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,有下列组合的混合烃①C2H4和C3H4 ②CH4和C2H4 ③CH4和C4H4 ④C2H2和C3H4
其中符合上述要求的是( )
其中符合上述要求的是( )
| A. | 只有② | B. | 只有②④ | C. | 只有②③④ | D. | 只有①②③ |
4.有部分元素的性质与原子(或分子)结构如下表:
(1)写出元素T的原子结构示意图: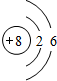 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示).下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式Na2O,Na2O2.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
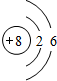 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示).下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式Na2O,Na2O2.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
8.在室温条件下,如下方法配制溶液,其浓度正确的是( )
| A. | 1mol Na2CO3固体溶于1L水中配成溶液,其物质的量浓度为1mol/L | |
| B. | 40g NaOH固体溶于100g水,配成的溶液质量百分比浓度为40% | |
| C. | 22.4L氨气溶于水配成1L溶液,其物质的量浓度为1mol/L | |
| D. | 1mol NaCl固体溶于水配成1L溶液,其物质的量浓度为1mol/L |
18.有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍.由三种元素组成的化合物的化学式不可能是( )
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
5.下列关于对卤素元素性质的比较说法中正确的是( )
| A. | 从上到下氢化物的熔沸点逐渐升高 | |
| B. | 从上到下单质的还原性逐渐减弱 | |
| C. | 从上到下最高价氧化物的水化物酸性逐渐减弱 | |
| D. | 从上到下原子得电子的能力逐渐增强 |
2.现有部分短周期元素的性质或原子结构如下表:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期ⅥA族;
②B元素原子结构示意图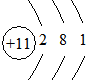 ;
;
③C单质分子的电子式 ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程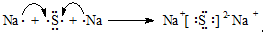 ;
;
④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素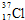 .
.
(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl(或Ba2++SO2+H2O2=BaSO4↓+2H+);
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:1:2.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期ⅥA族;
②B元素原子结构示意图
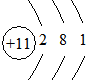 ;
;③C单质分子的电子式
 ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程 ;
;④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素
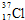 .
.(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl(或Ba2++SO2+H2O2=BaSO4↓+2H+);
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:1:2.
 Mn、Fe均为第四周期过渡元素.请回答下列问题:
Mn、Fe均为第四周期过渡元素.请回答下列问题: