题目内容
1.已知①氯水和溴水能将Fe2+氧化成Fe3+,而碘水不能;②Fe3+可以使KI-淀粉试液变蓝色.
(1)向100mL FeBr2溶液中通入标况下体积为3.36L的Cl2,充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为2mol/L;
(2)向含1molFeI2和2mol FeBr2溶液中通入3mol Cl2后,溶液中所含各种离子的个数之比是n(Fe3+):n(Br-):n(C1-)=1:1:2;
(3)向含a molFeI2和bmol FeBr2溶液中通入c mol Cl2,若要保证溶液中含有两种阳离子,c的取值范围是a<c<(1.5a+0.5b).
分析 根据①②可知,氧化性:Cl2>Fe3+>I2,还原性:I->Fe2+>Br-,
(1)还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br-的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-没有反应,溶液中n(Br-)=0.3mol,则n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,表示出参加反应的n(Br-),根据电子转移守恒列方程计算x值,再根据c=$\frac{n}{V}$计算;
(2)与相同氧化剂反应时,还原性越强的离子越先参加氧化还原反应,根据其还原能力大小顺序知,离子被氧化顺序是I->Fe2+>Br-,再结合氧化还原反应分析解答;
(3)要保证溶液中含有两种阳离子,则亚铁离子被氧化,且只能部分被氧化,则碘离子完全反应,溴离子不参与反应,据此进行讨论.
解答 解:根据①②可知,氧化性:Cl2>Fe3+>I2,还原性:I->Fe2+>Br-,
(1)还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br- 的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-没有反应,n(Br-)=0.3mol,则n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应,
设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3 mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得:x=0.2 mol,
所以原FeBr2溶液的物质的量浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:2mol/L;
(2)与相同氧化剂反应时,还原性越强的离子越先参加氧化还原反应,根据其还原能力大小顺序知,离子被氧化顺序是I->Fe2+>Br-,溶液中n(I-)=2mol,n(Fe2+)=3mol,n(Br-)=4mol,I-优先反应,其次是Fe2+,最后是Br-,
Cl2+2I-=I2+2Cl-
1mol2mol 2mol
1mol2mol 2mol
2Fe2++Cl2=2Fe3++2Cl-
2mol 1mol 2mol
3mol 1.5mol 3mol
2Br-+Cl2=2Cl-+Br2
2mol 1mol 2mol
1mol 0.5mol1mol
通过以上分析知,I-、Fe2+完全被氧化,Br-有3mol被氧化,根据方程式知,溶液中存在的离子是:Fe3+、Br-、Cl-,
根据原子守恒知,n(C1-)=3n( Cl2)=6mol,n(Br-)=3mol,n(Fe3+)=3mol,
溶液溶液中各种离子物质的量之比为:n(Fe3+):n(Br-):n(C1-)=3mol:3mol:6mol=1:1:2,
故答案为:n(Fe3+):n(Br-):n(C1-)=1:1:2;
(3)向含和溶液中通入c mol Cl2,若要保证溶液中含有两种阳离子,说明反应后溶液中含有铁离子和亚铁离子,即:亚铁离子只能部分被氧化,根据还原性I->Fe2+>Br-可知,I-完全被氧化,Fe2+部分被氧化,Br-没有参与反应,
a molFeI2中含有2amolI-、amolFe2+,bmol FeBr2中含有bmolFe2+,故溶液中总共含有(a+b)molFe2+,
根据反应Cl2+2I-=I2+2Cl-、2Fe2++Cl2=2Fe3++2Cl-可知,氧化2amol碘离子需要消耗amol氯气,氧化(a+b)molFe2+,需要消耗0.5(a+b)mol氯气,
当溶液中铁离子和亚铁离子同时存在时,即亚铁离子部分被氧化,氯气的物质的量范围为:a<c<(1.5a+0.5b),
故答案为:a<c<(1.5a+0.5b).
点评 本题考查了氧化还原反应的计算、有关范围讨论的计算,题目难度中等,明确粒子氧化性、还原性强弱为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |
| A. | 40g SO3气体所占有的体积为11.2L | |
| B. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-总数小于NA | |
| D. | 常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
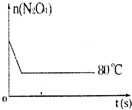 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)80℃该反应的平衡常数K=1.8mol•L-1.
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填序号)D,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)AB.
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线.

下列叙述错误的是( )
| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 步骤(2)产物中残留的烯丙醇可用溴水检验 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 |
| A. | 2.3 g Na被O2完全氧化生成Na2O和Na2O2混合物时,失去电子数为0.1~0.2 NA | |
| B. | 常温下,64 g SO2所含的氧原子数为2NA | |
| C. | 标准状况下,等物质的量的SO2和SO3所占体积相同 | |
| D. | 100 mL 0.1 mol•L-1的硫酸铝溶液中含有的Al3+为0.02NA个 |
(1)向酸化的海水中通入适量的氯气,使溴离子转化为单质溴:2NaBr+Cl2═Br2+2NaCl
(2)向吸收塔内的溶液中通入适量的氯气:2HBr+Cl2═2HCl+Br2
(3)蒸馏法将海水浓缩,用硫酸将浓缩的海水酸化
(4)向含有溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的:Br2+SO2+2H2O═2HBr+H2SO4
(5)用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质.
正确的顺序是( )
| A. | (1)(2)(3)(4)(5) | B. | (3)(1)(4)(2)(5) | C. | (5)(1)(3)(2)(4) | D. | (5)(4)(3)(2)(1) |
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
(1)五种元素中原子半径最大的元素是Na(填元素符号),画出该元素的原子结构示意图:
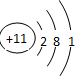
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属离子化合物(填“离子化合物”或“共价化合物”),存在的化学键是离子键、共价键.写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:NH4NO3+NaOH═NaNO3+NH3•H2O
(3)写出下列反应的化学方程式:Z的单质与Y元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.