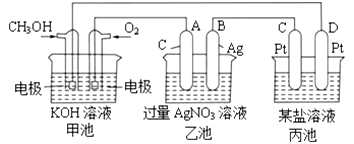
题目内容
【题目】根据题目提供的溶度积数据进行计算并回答下列问题:
(1)T℃时,在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(![]() )=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
)=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
[已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为________。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________________________。
②完全沉淀后,溶液的pH=________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?________(填“是”或“否”)。
【答案】是 蓝色 1.0×10-7mol·L-1 2 否
【解析】
(1) Ksp(CaCO3)=4.96×10-9 ,若c(CO32-)=10-3mol/L,则c(Ca2+)=4.96×10-9÷10-3=4.96×10-6<10-5 mol/L,所以Ca2+沉淀完全了;
(2) 25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,根据反应Mg(OH)2(s)![]() Mg2++2OH-可得:c(Mg2+)c2(OH-)=5.6×10-12,设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,解得:x=2.24×10-4mol/L,则根据室温下水的离子积常数Kw= c(H+)c(OH-)=10-14,可得c(H+)=
Mg2++2OH-可得:c(Mg2+)c2(OH-)=5.6×10-12,设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,解得:x=2.24×10-4mol/L,则根据室温下水的离子积常数Kw= c(H+)c(OH-)=10-14,可得c(H+)=![]() mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色;
mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色;
(3)①反应前,n(Ag+)=0.018 mol/L×0.05 L=9×10-4 mol,n(Cl-)=0.020 mol/L×0.05L=1×10-3 mol;反应后剩余的Cl-为1×10-4 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol/L,c(Ag+)=Ksp(AgCl)÷c(Cl-)=1.0×10-7 mol/L;
②H+没有参与反应,完全沉淀后,c(H+)=0.020mol/L÷2=0.010 mol/L,所以反应后溶液中pH=2;
③再向反应后的溶液中加入50mL0.001mol/L盐酸,由于加入盐酸中c(Cl-)与反应后溶液中的c(Cl-)相同,c(Cl-)不变,但c(Ag+)由于盐酸加入,溶液的体积增大而变小,所以Qc= c(Ag+) c(Cl-)<Ksp(AgCl),因此没有沉淀产生。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案