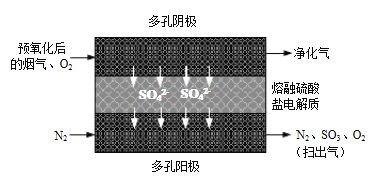
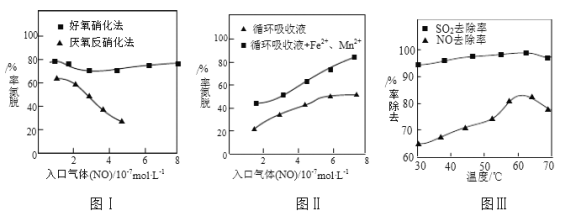
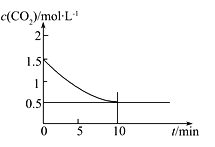
题目内容
【题目】把![]() L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用![]() mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗![]() molBaCl2,则原溶液中
molBaCl2,则原溶液中![]() (NO
(NO![]() )为( )
)为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·1-1
mol·1-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
【答案】B
【解析】bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol。令每份中NO3-的物质的量为n,根据溶液不显电性,则:bmol×1=cmol×2+n×1;解得n=(b-2c)mol。每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)= ![]() =
= ![]() mol/L。即原溶液中硝酸根的浓度为
mol/L。即原溶液中硝酸根的浓度为 ![]() mol/L。答案选B。
mol/L。答案选B。

【题目】下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是_________,除⑩外原子半径最大的是________。
(2)①③⑤三种元素最高价氧化物对应的水化物碱性最强的是__________ ;⑧⑨形成氢化物的稳定性由强到弱顺序为_________________。
(3)①②③⑤⑧五种元素形成的离子半径由大到小的顺序为______________________
(4)元素⑥的名称是____;元素④的原子结构示意图是/span>_______;元素⑦的氢化物和元素①单质反应的化学方程式为________________。
(5)①⑨形成的化合物灼烧时火焰焰色为________;该化合物的溶液与元素⑧的单质反应的化学方程式为_______________________。
(6)①、⑤和⑧最高价氧化物对应的水化物之间两两相互反应的离子方程式为____________________。
(7)元素③的单质在元素⑥⑦形成的某化合物中燃烧的化学方程式为____________________。