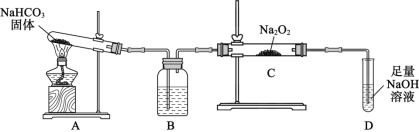
题目内容
【题目】中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
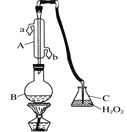
(1)仪器A的名称是______________,水通入A的进口为________。(a/b)
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__。
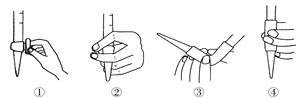
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________(酚酞/甲基橙);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____________________。
【答案】冷凝管(或冷凝器) b SO2+H2O2=H2SO4 ③ 酚酞 ④ 0.24 原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响
【解析】
(1)仪器为冷却装置,结合仪器A特点书写其名称,为了充分冷却气体,应该下口进水;
(2)根据SO2的还原性及H2O2的氧化性分析;
(3)根据碱性溶液盛放在碱式滴定管中,结合滴定管的结构判断;根据滴定终点时溶液的pH及常见指示剂的变色范围选用正确的指示剂;
(4)利用关系式2NaOH~H2SO4~SO2,用NaOH的物质的量计算出SO2的质量,再计算出该葡萄酒中的SO2含量;
(5)结合盐酸是挥发性酸,挥发的酸消耗NaOH判断对测定结果的影响。
(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以进水口为b;
(2)SO2具有还原性,H2O2具有氧化性,二者会发生氧化还原反应产生硫酸,反应的化学方程式是:SO2+H2O2=H2SO4;
(3)NaOH溶液盛在碱式滴定管中,要选择碱式滴定管驱赶气泡的方法装置是使用③;滴定终点时溶液的pH=8.8,应该选择碱性范围内变色的指示剂误差较小,由于酚酞的变色范围是8.2~10.0,甲基橙变色范围是3.1~4.4,所以选择酚酞作指示剂。若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,由于在下端尖嘴处还有一段玻璃管没有刻度也盛有碱溶液,所以管内液体的体积>40mL,故合理选项是④;
(4) 根据2NaOH~H2SO4~SO2可知SO2的物质的量为n(SO2)=1/2n(NaOH)=1/2×(0.0900mol/L×0.025L)=0.001125mol,其质量是m(SO2)=0.001125mol×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:0.072g ÷0.3L=0.24g/L;
(5)盐酸是挥发性酸,挥发的盐酸会消耗氢氧化钠,使得反应过程中消耗的氢氧化钠溶液体积增大,导致测定结果偏高;故改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】根据题目提供的溶度积数据进行计算并回答下列问题:
(1)T℃时,在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(![]() )=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
)=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
[已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为________。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________________________。
②完全沉淀后,溶液的pH=________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?________(填“是”或“否”)。