题目内容
6.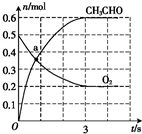 100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.
100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.回答下列问题:
(1)a点时,c(C2H4)等于2c(CH3CHO)(填“大于”“小于”或“等于”).
(2)前3s内,平均反应速率v(C2H4)为0.2mol•L-1•s-1.
(3)5s时改变反应温度为T℃,v(CH3CHO)以0.01mol•L-1•s-1的平均速率减小,经t1 s后达到平衡,平衡时测得c(C2H4)=c(CH3CHO).
①T大于100℃(填“大于”或“小于”).
②t1=5,该条件下反应的平衡常数K=8.
分析 (1)a点时,由图象可知氧气物质的量为0.35mol,又乙烯和氧气物质的量之比为2:1,2C2H4 (g)+O2(g)?2CH3CHO,乙烯与氧气又按照2:1反应,所以C2H4物质的量为0.35mol×2=0.7mol,据此分析;
(2)前3s内,根据平均反应速率v(C2H4)=$\frac{△c}{△t}$计算;
(3)根据图象得出100℃平衡时氧气、乙醛分别为$\frac{0.2}{2}$=0.1mol•L-1、$\frac{0.6}{2}$=0.3mol•L-1,又乙烯和氧气物质的量之比为2:1,所以乙烯平衡浓度为0.2mol•L-1,乙烯小于乙醛,温度为T℃,平衡时测得c(C2H4)=c(CH3CHO),所以平衡逆向移动,再根据c(C2H4)=c(CH3CHO).用三段式求出再次平衡时的浓度进行计算.
解答 解:(1)a点时,由图象可知氧气物质的量为0.35mol,又乙烯和氧气物质的量之比为2:1,2C2H4 (g)+O2(g)?2CH3CHO,乙烯与氧气又按照2:1反应,所以C2H4物质的量为0.35mol×2=0.7mol,再根据图象a点时CH3CHO的物质的量为0.35,所以c(C2H4)等于2c(CH3CHO),故答案为:等于;
(2)前3s内,根据平均反应速率v(C2H4)=2v(O2)=$\frac{△c}{△t}$=2×$\frac{0.5-0.2}{3}$=0.2mol•L-1•s-1,故答案为:0.2;
(3)①根据图象得出100℃平衡时氧气、乙醛分别为$\frac{0.2}{2}$=0.1mol•L-1、$\frac{0.6}{2}$=0.3mol•L-1,又乙烯和氧气物质的量之比为2:1,所以乙烯平衡浓度为0.2mol•L-1,乙烯小于乙醛,温度为T℃,平衡时测得c(C2H4)=c(CH3CHO),所以平衡逆向移动,又逆反应为吸热反应,则升高温度,所以T大于100℃,故答案为:大于;
②2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0 设平衡逆向移动生成氧气xmol/L,
开始(mol/L)0.2 0.1 0.3
转化(mol/L)2x x 2x
平衡(mol/L)0.2+2x 0.1+x 0.3-2x
根据c(C2H4)=c(CH3CHO)则0.2+2x=0.3-2x,x=0.025mol•L-1,即乙醛的变化量为0.025×2=0.05mol•L-1,所以t1=$\frac{0.05}{0.01}$=5s,K=$\frac{c(CH{\;}_{3}CHO){\;}^{2}}{c(C{\;}_{2}H{\;}_{4}){\;}^{2}c(O{\;}_{2})}$=$\frac{(0.3-2×0.025){\;}^{2}}{(0.2+2×0.025){\;}^{2}×(0.1+0.025)}$=8,故答案为:5;8.
点评 本题根据图象考查化学平衡移动的原理,关键根据三段式进行计算,难度不大,难点为(3).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案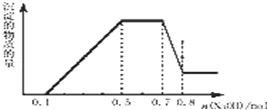 溶液中可能含有 H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入 NaOH 溶液,产生白色沉淀,且产生的沉淀量与加入 NaOH 的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有 H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入 NaOH 溶液,产生白色沉淀,且产生的沉淀量与加入 NaOH 的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中一定不含 CO32-,可能含有 SO42-和 NO3- | |
| B. | n(H+):n(NH4+):n(Mg2+)=2:4:1 | |
| C. | 溶液中的阳离子只有 H+、Mg2+、Al3+ | |
| D. | 在滴加 NaOH 溶液物质的量为 0.5 至 0.7mol 时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
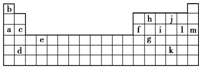 下表是元素周期表的一部分.下表中所列的字母分别代表某一种元素.
下表是元素周期表的一部分.下表中所列的字母分别代表某一种元素.(1)下列①④(填写编号)组元素的单质可能都是电的良导体.
①a、c、h ②b、g、k③c、h、l ④d、e、f
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是AB.
A.ib3 B.hl4 C.il5 D.hb4
(3)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子所需的能量主要受两大因素的影响:a.原子核对核外电子的吸引力b.形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量(kJ•mol-1)
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
②用电子式(相应元素符号)表示化合物X2j2的形成过程
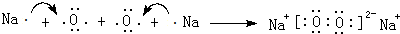 .
.③Y是周期表中的ⅢA族元素.以上13种元素中,Ar元素原子(填写元素符号)失去核外第一个电子需要的能量最多.
| A. | 只含有1个双键的环状有机物 | B. | 含2个双键的链状有机物 | ||
| C. | 环状有机物 | D. | 含一个三键的链状有机物 |
| A. | 增大亚硫酸钠粉末的量 | |
| B. | 硫酸浓度增大一倍,用量减少到原来的$\frac{1}{2}$ | |
| C. | 硫酸浓度不变,用量增大一倍 | |
| D. | 使反应在较低温度下进行 |
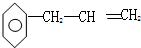 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 能使高锰酸钾溶液褪色 | B. | 能使溴水褪色,且静置后分层 | ||
| C. | 不能发生取代反应 | D. | 可以燃烧 |
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后计算:
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后计算: