题目内容
17.在一密闭容器内盛由HI气体.在一定温度下进行反应:2HI(g)?H2(g)+I2(g)(正反应为放热反应)达平衡.若升高温度,则①正反应速率加快,逆反应速率加快(填“加快”“减慢”或“不变”)
②化学平衡向逆反应方向移动(填“正反应方向”“逆反应方向”或“不”)
③混合气体的颜色应变浅(填“深”、“浅”或“不变”)
④混合气体平均相对分子质量不变化学平衡常数将变小(填“增大”、“减小”或“不变”)
分析 ①升高温度,正逆反应速率都加快;
②升高温度化学平衡向着吸热方向进行,又该反应2HI(g)?H2(g)+I2(g)(正反应为放热反应),所以平衡向逆反应方向移动;
③升高温度化学平衡向着吸热方向进行即逆反应方向移动,根据混合气颜色与I2单质浓度成正比判断;
④因为反应前后质量不变,物质的量也不变,所以混合气体平均相对分子质量不变,又升高温度化学平衡向着吸热方向进行即逆反应方向移动,所以化学平衡常数将变小.
解答 解:①升高温度,单位体积内的活化百分数增大,则活化分子增多,所以正逆反应速率都加快,故答案为:加快;加快;
②升高温度化学平衡向着吸热方向进行,又该反应2HI(g)?H2(g)+I2(g)(正反应为放热反应),所以平衡向逆反应方向移动,
故答案为:逆反应方向;
③升高温度化学平衡向着吸热方向进行即逆反应方向移动,所以I2单质浓度减小,颜色变浅,
故答案为:浅;
④因为反应前后质量不变,物质的量也不变,所以混合气体平均相对分子质量不变,又升高温度化学平衡向着吸热方向进行即逆反应方向移动,所以化学平衡常数将变小,故答案为;不变;变小.
点评 本题考查影响化学平衡移动的因素,难度不大.要熟练掌握勒夏特列原理.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
3.一定条件下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),的化学平衡常数K=1,相同条件下,当C(CO2)=0.5mol•L-1、C(H2)=0.5mol•L-1、C(CO)=1mol•L-1、C(H2O)=1mol•L-1时,下列说法正确的是( )
| A. | 处于平衡状态,正逆反应速率相等 | |
| B. | 平衡逆移,正反应速率小于逆反应速率 | |
| C. | CO2的转化率为50% | |
| D. | 该条件下,学平衡常数K=4 |
5.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,下列有关说法中错误的是( )
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越小,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以AgCl可以转化为AgI | |
| D. | 一定温度下,向AgCl的饱和溶液中加入NaCl固体,有AgCl固体析出 |
2.某无色溶液能与铝粉反应生成氢气,则下列各组离子在该溶液中一定能大量共存的是( )
| A. | Fe2+ Na+ SO42- NO3- | B. | K+、Na+、Cl-、SO42-、 | ||
| C. | Ag+ K+ Ba2+ NO3- | D. | Mg2+ Ca2+ Cl- SO42- |
7.已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:
(1)试比较U、V、W三种元素电负性F>O>N(用元素符号填空),X、Y两元素中X的第一电离能较大的原因是原子价电子排布为3s2,而Al原子的价电子排布为3s23p1,Mg原子3s轨道全充满,3p轨道全空相对稳定
(2)基态Z原子的核外电子排布式为[Ar]3d54s1.该基态原子共有24种不同运动状态的电子.
(3)试写出U元素单质的2种等电子体,①CO,②CN-.
(4)将W的单质通入NaOH溶液中可得到VW2.VW2是一种无色、几乎无味的剧毒气体,主要用于氧化反应,火箭工程、助燃剂等.
①VW2中V原子的杂化轨道类型是sp3,VW2分子的空间构型为V形.
②与H2O分子相比,VW2分子的极性更小(填“大”或“小”),原因是F的电负性大于O,导致正负电荷中心偏离程度减小.
(5)金属Z内部原子的堆积方式与Na相同,都是体心立方堆积方式.则晶胞中Z的配位数为8,若该晶胞的边长为289pm,NA取值为6.02×1023,Z原子的摩尔质量为52g/mol,则Z的密度为7.1g/cm3.Z原子与次近的Z原子的核间距离为289pm.
| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
(2)基态Z原子的核外电子排布式为[Ar]3d54s1.该基态原子共有24种不同运动状态的电子.
(3)试写出U元素单质的2种等电子体,①CO,②CN-.
(4)将W的单质通入NaOH溶液中可得到VW2.VW2是一种无色、几乎无味的剧毒气体,主要用于氧化反应,火箭工程、助燃剂等.
①VW2中V原子的杂化轨道类型是sp3,VW2分子的空间构型为V形.
②与H2O分子相比,VW2分子的极性更小(填“大”或“小”),原因是F的电负性大于O,导致正负电荷中心偏离程度减小.
(5)金属Z内部原子的堆积方式与Na相同,都是体心立方堆积方式.则晶胞中Z的配位数为8,若该晶胞的边长为289pm,NA取值为6.02×1023,Z原子的摩尔质量为52g/mol,则Z的密度为7.1g/cm3.Z原子与次近的Z原子的核间距离为289pm.

 .
.
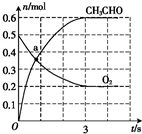 100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.
100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.