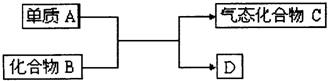
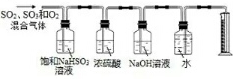
题目内容
16.将有Na2CO3•xH2O和NaHCO3组成的固体混合物31.6g,用酒精灯加热到反应完全,并将反应后的产物依次通过盛有浓H2SO4的洗气瓶和盛有碱石灰的干燥管,二者分别增重13.5g和2.2g(假定产物吸收完全).求:(1)混合物中NaHCO3的质量;
(1)x的值.(要求写出计算过程)
分析 (1)加热发生反应:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O、Na2CO3•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +xH2O,产物依次通过盛有浓H2SO4的洗气瓶和盛有碱石灰的干燥管,增重13.5g,为水的质量,2.2g为二氧化碳的质量,残留固体为碳酸钠,碳酸氢钠加热分解生成二氧化碳,根据二氧化碳的质量结合方程式计算碳酸氢钠的质量;
(2)根据根据二氧化碳的质量结合方程式计算碳酸氢钠分解生成水的质量,进而计算碳酸钠晶体分解生成水的质量,再计算碳酸钠晶体的质量,根据方程式计算x的值.
解答 解:(1)加热发生反应:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O、Na2CO3•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +xH2O,增重13.5克为生成的水的质量,增重2.2克为生成的CO2的质量碳酸氢钠加热分解生成二氧化碳为2.2g,则:
2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O
168 44
m(NaHCO3) 2.2g
所以m(NaHCO3)=$\frac{168×2.2}{44}$=8.4g
答:混合物中NaHCO3的质量是8.4g;
(2)2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O
44 18
2.2g 0.9g
故碳酸钠晶体加热分解生成水的质量=13.5g-0.9g=12.6g,碳酸钠晶体的质量=31.6g-8.4g=23.2g,
Na2CO3•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +xH2O
(106+18x) 18x
23.2g 12.6g
解得x=10,
答:x的值是10.
点评 本题考查混合物计算、化学方程式有关计算,明确发生的反应是解题关键,综合考查学生分析问题、处理数据的能力,难度中等.

| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
(2)基态Z原子的核外电子排布式为[Ar]3d54s1.该基态原子共有24种不同运动状态的电子.
(3)试写出U元素单质的2种等电子体,①CO,②CN-.
(4)将W的单质通入NaOH溶液中可得到VW2.VW2是一种无色、几乎无味的剧毒气体,主要用于氧化反应,火箭工程、助燃剂等.
①VW2中V原子的杂化轨道类型是sp3,VW2分子的空间构型为V形.
②与H2O分子相比,VW2分子的极性更小(填“大”或“小”),原因是F的电负性大于O,导致正负电荷中心偏离程度减小.
(5)金属Z内部原子的堆积方式与Na相同,都是体心立方堆积方式.则晶胞中Z的配位数为8,若该晶胞的边长为289pm,NA取值为6.02×1023,Z原子的摩尔质量为52g/mol,则Z的密度为7.1g/cm3.Z原子与次近的Z原子的核间距离为289pm.
| A. | CO2+H2O═H2CO3 | B. | C+O2═CO2 | ||
| C. | CO2+2KOH═K2CO3+H2O | D. | CaO+CO2═CaCO3 |
| A. | 在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
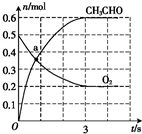 100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.
100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.