题目内容
将128 g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到NO2和NO的混合气体44.8 L气体(标准状况),求:
(1)写出上述过程中,有关反应的化学方程式(4分)。
______________________________________________________、
______________________________________________________。
(2)完成该反应至少需要量取10mol/L的浓硝酸_________mL(4分)。
(3)求混合气体中NO2、NO的体积(6分,请写出计算步骤)。
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,求理论上需要参加反应的O2的物质的量(4分,请写出计算步骤)。
(共18分,本大题其它合理解法也得分)
(1)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+ 2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+ 4H2O
(2)根据N元素守恒,HNO3被还原后生成NO2、NO,混合气体中
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+ 2H2O
4 2
n(浓HNO3)=2mol 1mol
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+ 4H2O
8 2
n(稀HNO3)=4mol 1mol
故 n(HNO3) =6mol
V (HNO3) = n(HNO3) / c(HNO3) =" 6mol" / (10mol/L) =" 0.6" L =" 600mL"
(3)设混合气中n(NO2)=x n(NO)="y" ,则x+y="44.8" L/ 22.4 L /mol = 2mol-----①(2分)
根据反应方程式
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+ 2H2O
1 2
0.5x x
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+ 4H2O
3 2
1.5y y
0.5x+1.5y ="128" g / (64 g/mol) = 2mol----②(2分)
联立方程式得 x=1mol y="1mol" (1分)
所以V(NO2)= 1mol ×22.4 L /mol=22.4L V(NO)=" 1mol" ×22.4 L /mol="22.4L" (1分)
(4)根据电子守恒,可得:
2Cu —— O2 (2分)
128 1
128g n(O2)=1mol (2分)
解析试题分析:(1)、浓硝酸与铜反应式为Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+ 2H2O,反应进行到一定程度,浓硝酸变为稀硝酸,反应式变为3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+ 4H2O;(2)、由m/M可知n(Cu)=2mol,由V/Vm可知n(NO2)+n(NO)=2mol,设被浓硝酸氧化的铜为xmol,被硝酸氧化的铜为ymol,由反应式可知生成2xmolNO2、2y/3molNO,则x+y=2、2x+2y/3=2,解方程组,x=0.5,y=1.5;由反应式可知共消耗的n(HNO3)=(4x+8y/3)mol=6mol,由n/c可知V=0.6L=600mL;(3)、由n?Vm可知,V(NO2)=11.2L,V(NO)=33.6L;(4)、NO2与O2溶于水变成硝酸的反应式为4 NO2+O2+2H2O=4HNO3,NO与O2溶于水变成硝酸的反应式为4 NO+3O2+2H2O=4HNO3,由反应式可知氧化NO2的O2为1mol/4,氧化NO的O2为3×1/4mol,因此理论上共消耗的O2为1mol/4+3×1/4mol=1mol。
考点:考查硝酸的性质、物质的量在化学方程式计算中的应用、氮氧化物的性质等相关知识。

我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原理是
| A.胶体的电泳 | B.血液的氧化还原反应 |
| C.血液中发生复分解反应 | D.胶体的聚沉 |
 和
和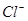 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。 Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6S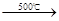 Na2SO4+2HCl↑
Na2SO4+2HCl↑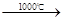 Na2S+2CO2↑
Na2S+2CO2↑