题目内容
金属及其化合物变化多,用途广。请完成下列计算:
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g。它在空气中灼烧后的产物中Mg3N2的质量分数是 (用a、b表示,只考虑空气中氮气、氧气参与反应)。
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度。
②计算并确定此种硬铝的化学式。
(3)取5.1g Al-Mg合金与200mL 1mol·L-1的NaOH(aq)充分反应,产生气体a L。过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全。过滤、洗涤、干燥、灼烧,得到固体5.1 g。则a = ,V = 。(气体体积均为标准状况)
(4)向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6 mol·L-1 HNO3(aq),恰好完全溶解,同时收集到1120 mL NO(标准状况)。通过计算推断混合粉末中Cu的物质的量。
(1) (2分)
(2分)
(2)①12.8 mol/L (3分)
②设硬铝中: Al x mol 、Cu y mol
x=0.02mol,y=" 0.01" mol 所以该硬铝的化学式为Al2Cu 。 (3分)
(3)a= 3.36(2分) 、 V= 1.12 (2分)
(4)0.025<n(Cu)<0.075 (4分)
解析试题分析:
(1)在氧气中生成氧化镁,在空气中生成氧化镁和假设在相同量1mol的镁分别在氧气和空气燃烧,那么质量相差为1molMgO(40g),1/3 mol Mg3N2(100/3)g,质量相差40g-(100/3)g=20/3 g,要使质量相差b g,则生成Mg3N2的质量为(100/3)*b/(20/3 )g,=5b,而空气中灼烧后的产物质量为a-b,Mg3N2的质量分数是 。
。
考点:考查根据差量法来解题的能力。
(2)根据电子的是守恒:金属失去的电子=HNO3得到的电子="NO" NO2混合气体失去的电子=氧气得到的电子 n(O2)=0.448/22.4=0.02mol则转移电子的物质的量n(e-)=0.02*4=0.08mol
设合金中n(Al)="xmol" n(Cu)=ymol则3x+2y=0.08
27x+64y=1.18得到x=0.02 y=0.01 NO2 NO混合气体中
设NO物质的量=a,则NO2物质的量=2a;3a+2a=0.08;a=0.016
n(HNO3)=0.02*3+0.01*2+3*0.016=0.128mol;c(HNO3)=0.128/0.01=12.8mol/L;
合金化学式为Al2Cu
考点:考查根据元素守恒法和电子守恒法的运用。
(3)产生气体a L为氢气,2AL-----3H2 灼烧,得到固体5.1 g是氧化铝,其物质的量为0.05mol,根据铝元素守恒可知AlO2-的物质的量为0.1mol,根据关系式2AlO2- ------可求出CO2的物质的量为0.05mol,故V= 1.12,根据关系式2AL-----3H2 求得氢气物质的量为0.15mol,故a= 3.36
考点:考查根据元素守恒法的运用。
(4)本题为混合物的计算,若建立方程组求解,则解题过程较为繁琐。若抓住反应的始态和终态利用守恒关系进行求解,则可达到化繁为简的目的。
利用氮(N)原子守恒。n(HNO3)= 0.3mol,n(NO)= 0.05mol,则n(Cu(NO3)2)=(0.3-0.05)/2=0.125mol
本题混合物中虽含有Cu、Cu2O和CuO三种物质,但参加氧化还原反应的只有 Cu、Cu2O,所以利用电子守恒可直接求解。转移电子总数:n(e-)= n(NO)×3=0.15mol
设Cu的物质的量为Xmol,Cu则提供电子数:2Xmol
Cu2O提供电子数: 0.15-2Xmol
n(Cu2O)=(0.15-X)/2 mol n(CuO)= 0.125-X-(0.15-2X)=0.025-X
根据电子守恒进行极端假设:
若电子全由Cu提供则n(Cu)=0.075mol;
若电子全由Cu2O提供则n(Cu2O)=0.075mol,则n(Cu2+)>0.125mol,不可能,但n(CuO)= 0.125-X-(0.15-2X)=-0.025+X>0,解得X>0.025
所以0.025mol < n(Cu)<0.075mol。
考点:考查根据电子守恒法的运用。

铁铝合金是一种新型高温结构材料。
(1)图9表示室温时不同组份的Fe3Al在65%浓HNO3 中的腐蚀情况。由图9可看出添加了 (填符号)元素的合金耐蚀性最差。
(2)高温条件下,Al和Fe2O3按一定比例混合反应可制
|
①小明同学提出如下方案:准确称取1.46g该合金粉末,再加入足量NaOH溶液(Si+2NaOH+H2O=Na2SiO3+2H2↑),充分反应后过滤,通过测定剩余固体质量及收集到气体的体积,可计算出此合金的组成。写出Al与NaOH溶液反应的离子方程式 。
②小军同学认为该方案难以测定标准状况下气体的体积,操作不简便。于是他设计了第二种方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g。试通过计算确定此合金的组成。
奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
________________________________________________________________________________________________________________________________________________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
| A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 |
| B.定容时,俯视刻度线 |
| C.定容时,仰视刻度线 |
| D.移液时,有少量液体溅出 |
[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
下列物质中,属于酸性氧化物但不溶于水的是( )
| A.Al2O3 | B.CO2 | C.SO3 | D.SiO2 |

 2O3
2O3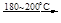 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。