题目内容
已知常温、常压下:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
 2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是| A.2Q2=Q1=92.4 | B.Ql<Q2<92.4 | C.Q2<Q1<92.4 | D.Ql=Q2<92.4 |
C
试题分析:由于该反应是可逆反应,所以反应物的转化率得不到100%,则Q1<92.4。另一容器中由于最初加入了1mol氨气,所以放出的热量更少,答案选C。
点评:反应热的数值大小是和方程式中化学计量数有关系的,即该题中表示消耗1mol氮气时放热是92.4kJ,所以在可逆反应中必须根据反应物的转化率才能计算反应放出的实际热量大小。

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
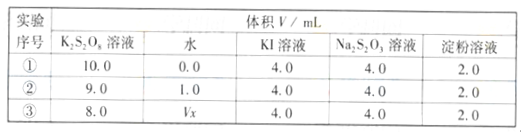
 ② (CH3)3COH
② (CH3)3COH  O2(g)
O2(g) CO(g) ΔH1 = —110.5 kJ/mol
CO(g) ΔH1 = —110.5 kJ/mol