题目内容
有反应4HCl+O2→2Cl2+2H2O,已知2molO2被还原时,放出a kJ的热量,且知断开1molO2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl 键所需能量高
| A.(a+b-2c)/4 | B.(a+2b-4c)/8 | C.(b-a-2c)/4 | D.(2b-a-4c)/8 |
B
试题分析:2molO2被还原时,放出a kJ的热量可得出:4HCl(g)+O2(g)=2Cl2(g)+2H2O(?) ΔH=-a/2kJ/mol;设断开1 mol H—O键吸收xkJ,断开1 mol H—Cl 键吸收ykJ,ΔH=4×y+b-(2c+4x)=-a/2;x-y=
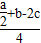 ;B正确。
;B正确。点评:反应热等于反应物键能之和减去生成物键能之和。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目


 (g)+CO(g)
(g)+CO(g) CH
CH OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol

 移向__________电极(填Fe或C);
移向__________电极(填Fe或C); 溶液。
溶液。
 2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是