题目内容
1 mol CH4气体完全燃烧放出的热量为890 kJ,但当不完全燃烧生成CO和H2O(l)时,放出的热量为607 kJ,如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出819.25 kJ的热量,则一定量O2的质量为 ( )
| A.40 g | B.56 g |
| C.60 g | D.无法计算 |
C
试题分析:由题意可知,甲烷完全燃烧的热化学方程式为CH4 (g)+2O2(g)=CO2 (g)+2H2O(l) ΔH=-890 kJ·mol-1;同理不完全燃烧的热化学方程式为CH4 (g)+3/2O2 (g)=CO(g)+2H2O(l)ΔH=-607 kJ·mol-1。设不完全燃烧、完全燃烧的CH4的物质的量分别是x、y,则x+y="1" mol、607·x +802·y=819.25 kJ
解得x="0.25" mol、y="0.75" mol
则消耗氧气的质量是(0.25×1.5+0.75×2)mol×32g/mol=60g,答案选C。
点评:该题是中等难度的试题,试题注重基础、灵活性强。主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力。

练习册系列答案
相关题目
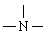 存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。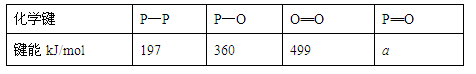
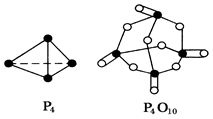
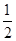 O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol 2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是