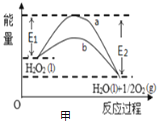
题目内容
【题目】现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数与s电子数相等 |
C基态原子的价电子排布为nsn-1npn+1 |
D的能层数与C相同,且电负性比C大 |
E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
F是前四周期中电负性最小的元素 |
G在周期表的第五列 |
(1)C基态原子中能量最高的电子,其电子云在空间有____个方向,原子轨道呈____形,C简单离子核外有___种运动状态不同的电子。
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是___;
②A2B2难溶于CS2,简要说明理由:________。
(3)G位于____族___区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为____;
(4)ED3分子的VSEPR模型名称为____,其中E原子的杂化轨道类型为____。
【答案】3 哑铃 18 冰中的水分子间有氢键,使水分子之间间隙增大,密度变小 因为H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2 ⅤB d V2O5 四面体形 sp3
【解析】
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,为H元素;B元素原子的核外p电子数与s电子数相等,B有2个电子层,为1s22s22p2,故B为C元素;C的价层电子排布为nsn-1npn+1,由于s能级最多容纳2个电子,且p能级容纳电子,故n=3,则C为S元素;非金属性越强电负性越大,D的能层数与C相同,且电负性比C大,则D为Cl元素;E为第四周期元素,主族序数与周期数的差为1,则为第四周期ⅤA族元素,且第一电离能比同周期相邻两种元素都大,为As元素;F是前四周期中电负性最小的元素,则为K元素;G在周期表的第五列,则为第四周期ⅤB族元素,为V元素;据此分析。
根据以上分析可知A为H元素,B为C元素,C为S元素,D为Cl元素,E为As元素,F为K元素,G为V元素。则
(1)C为S元素,基态原子中能量最高的电子在3p轨道,其电子云在空间有3种不同的方向,原子轨道呈纺锤形或哑铃形,C简单离子S2-核外有18个电子,故有18种运动状态不同的电子;
(2)①A2B为H2O,一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是冰中的水分子间有氢键,使水分子之间间隙增大,密度变小;
②因为H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2;
(3)G为V,位于第四周期ⅤB族d区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为V2O5;
(4)AsCl3分子中中心原子As上的孤电子对数为![]() (5-3×1)=1,As的成键电子对数为3,As的价层电子对数为1+3=4,AsCl3的VSEPR模型为四面体型,去掉孤电子对,AsCl3分子的立体构型为三角锥形;其中As原子的杂化类型为sp3杂化。
(5-3×1)=1,As的成键电子对数为3,As的价层电子对数为1+3=4,AsCl3的VSEPR模型为四面体型,去掉孤电子对,AsCl3分子的立体构型为三角锥形;其中As原子的杂化类型为sp3杂化。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
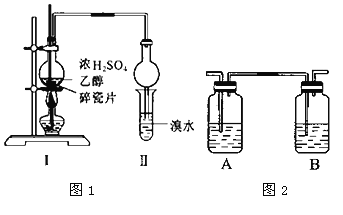
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。

(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
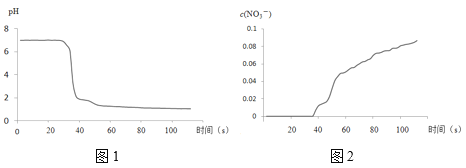
(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。