题目内容
 下列关于晶体的说法一定正确的是( )
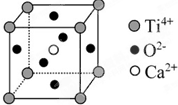
下列关于晶体的说法一定正确的是( )CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
| A、1mol NH3中含有电子数为8mol |
| B、常温常压下,12g金刚石中含有2mol C-C键 |
| C、SiO2晶体中每个硅原子与2个氧原子以共价键相结合 |
| D、CaTiO3晶体中每个Ti4+与12个O2-相紧邻 |
考点:晶胞的计算
专题:化学键与晶体结构
分析:A、每个氨分子中含有电子数为7+3=10,据此答题;
B、每个碳原子周围有四个C-C键,每个碳原子实际占有键的数目为4×
=2,12g碳即为1mol,含有2mol C-C键,据此答题;
C、在SiO2晶体中,每个硅原子周围有四个Si-O键,据此答题;
D、根据晶胞结构图可知,与Ti4+紧邻的O2-分布在与钛离子相连的面的面心上,这样的面共有12个,据此答题.
B、每个碳原子周围有四个C-C键,每个碳原子实际占有键的数目为4×
| 1 |
| 2 |
C、在SiO2晶体中,每个硅原子周围有四个Si-O键,据此答题;
D、根据晶胞结构图可知,与Ti4+紧邻的O2-分布在与钛离子相连的面的面心上,这样的面共有12个,据此答题.
解答:
解:A、每个氨分子中含有电子数为7+3=10,所以1mol NH3中含有电子数为10mol,故A错误;
B、每个碳原子周围有四个C-C键,每个碳原子实际占有键的数目为4×
=2,12g碳即为1mol,含有2mol C-C键,故B正确;
C、在SiO2晶体中,每个硅原子周围有四个Si-O键,所以每个硅原子与4个氧原子以共价键相结合,故C错误;
D、根据晶胞结构图可知,与Ti4+紧邻的O2-分布在与钛离子相连的面的面心上,Ti4+与相紧邻O2-有3×8×
=12个,故D正确;
故选BD.
B、每个碳原子周围有四个C-C键,每个碳原子实际占有键的数目为4×
| 1 |
| 2 |
C、在SiO2晶体中,每个硅原子周围有四个Si-O键,所以每个硅原子与4个氧原子以共价键相结合,故C错误;
D、根据晶胞结构图可知,与Ti4+紧邻的O2-分布在与钛离子相连的面的面心上,Ti4+与相紧邻O2-有3×8×
| 1 |
| 2 |
故选BD.
点评:本题主要考查分子的结构及晶体结构,难度不大,注重基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有关物质的结构和组成如图所示,下列说法中不正确的是( )
A、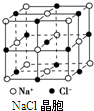 在如图所示NaCl晶体中,距Na+最近的Cl-形成正八面体 |
B、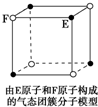 在如图所示气态团簇分子的分子式为EF或FE |
C、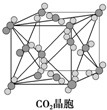 在如图所示CO2晶体中,一个CO2分子周围有12个CO2分子紧邻 |
D、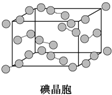 在如图所示碘晶体中,碘分子的排列有两种不同的方向 |
盆烯的分子结构如图所示(其中碳、氢原子均已略去).关于盆烯的说法正确的是( )
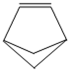

| A、盆烯的一氯取代物有4种 |
| B、盆烯是乙烯的一种同系物 |
| C、盆烯是苯的一种同分异构体 |
| D、盆烯为不饱和烃,能与氢气发生加成反应 |
下列叙述正确的是( )
| A、主族元素的最高正价等于该元素原子的核外电子数 |
| B、非金属元素的最高正价与最低负价的和等于8 |
| C、元素的原子失去电子后显负价 |
| D、主族元素的最高正价等于该元素所处的族序数(O、F元素除外) |
下列关于同系物的说法中,错误的是( )
| A、同系物具有相同的分子式 |
| B、同系物符合同一通式 |
| C、相邻的同系物彼此在组成上相差一个CH2原子团 |
| D、同系物的化学性质基本相似 |
下列说法中错误的是( )
| A、当中心原子的配位数为6时,配合单元常呈八面体空间结构 |
| B、SO3为平面正三角形结构 |
| C、已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 |
| D、配位数为4的配合物均为正四面体结构 |
含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A、非金属性比硫强 |
| B、氢化物比HBr稳定 |
| C、处于金属与非金属的分界线上 |
| D、最高价氧化物的水化物为H2SeO4 |
下列关于苯的同系物的命名说法中错误的是( )
| A、苯的同系物命名必须以苯作为母体,其他的基团作为取代基 |
| B、二甲苯可以以邻、间、对这种习惯方法进行命名 |
| C、二甲苯也可以用系统方法进行命名 |
| D、化学式是C8H10的苯的同系物有4种同分异构体 |
下列说法正确的是( )
| A、凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体 |
| B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 |
| D、凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |