题目内容
下列说法正确的是( )
| A、凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体 |
| B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 |
| D、凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
考点:原子轨道杂化方式及杂化类型判断,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:A、如果中心原子无孤电子对采取sp3杂化的分子,其立体构形都是正四面体;
B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的sp3杂化轨道形成4个σ键;
C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对;
D、凡AB3型的共价化合物,其中心原子周围有一对孤电子对A均采用sp3杂化轨道成键.
B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的sp3杂化轨道形成4个σ键;
C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对;
D、凡AB3型的共价化合物,其中心原子周围有一对孤电子对A均采用sp3杂化轨道成键.
解答:
解:A、如果中心原子无孤电子对采取sp3杂化的分子,其立体构形都是正四面体,故A错误;
B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的sp3杂化轨道形成4个σ键,故B错误;
C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对,故C正确;
D、凡AB3型的共价化合物,其中心原子周围有一对孤电子对A均采用sp3杂化轨道成键,故D错误;
故选C.
B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的sp3杂化轨道形成4个σ键,故B错误;
C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对,故C正确;
D、凡AB3型的共价化合物,其中心原子周围有一对孤电子对A均采用sp3杂化轨道成键,故D错误;
故选C.
点评:本题考查了原子杂化类型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数=
(a-xb)中各个字母的含义,难度中等.
| 1 |
| 2 |

练习册系列答案
相关题目
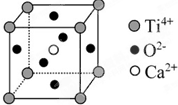 下列关于晶体的说法一定正确的是( )
下列关于晶体的说法一定正确的是( )CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
| A、1mol NH3中含有电子数为8mol |
| B、常温常压下,12g金刚石中含有2mol C-C键 |
| C、SiO2晶体中每个硅原子与2个氧原子以共价键相结合 |
| D、CaTiO3晶体中每个Ti4+与12个O2-相紧邻 |
下列叙述正确的是( )
| A、0.01mol/L CH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性 |
| B、0.1mol/L NaHCO3溶液中c(OH-)=c(H+)+c(CO32-)+2c(H2CO3) |
| C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA-)+2c(A2-) |
| D、100mL 1.0 mol?L-1 Fe(NO3)2溶液和100mL 2.0 mol?L-1 HNO3溶液混合后:c(NO3-)=2.0mol?L-1 |
要除去混在石英中的少量碳酸钙,应采取的方法是( )
| A、加水溶解后,过滤分离 |
| B、加稀盐酸溶解后,过滤分离 |
| C、加NaOH溶液溶解后,过滤分离 |
| D、用酒精灯加热 |
某研究性学习小组为了评价当地雨水的酸度(酸性强弱),选用下列检测试剂,正确的是( )
| A、PH值试纸 |
| B、酚酞试液 |
| C、淀粉碘化钾试纸 |
| D、红色石蕊 |
下列配合物的配位数不是6的是( )
| A、K3[Fe(SCN)6] |
| B、Na2[SiF6] |
| C、Na3[AlF6] |
| D、[Cu(NH3)4]Cl2 |
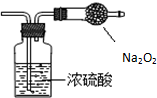 某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减小,通过干燥管后(干燥管未与空气接触)气体呈红棕色,则下列推断正确的是( )
某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减小,通过干燥管后(干燥管未与空气接触)气体呈红棕色,则下列推断正确的是( )| A、原气体中一定有NO和O2 |
| B、原气体中一定有NO、CO2 |
| C、原混合气体中可能有HCl、Br2、O2 |
| D、原气体中一定没有HCl、Br2、CO2 |
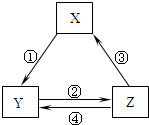 下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )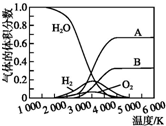 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.